题目内容
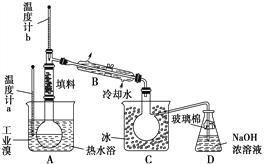
【题目】将铁粉和活性炭的混合物用NaCl溶液浸润后,置于如图装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
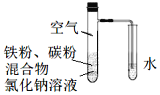
A.铁被氧化的电极反应式为Fe–3e=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
【答案】C
【解析】
铁粉、碳粉与氯化钠溶液能构成原电池,铁粉作负极,发生吸氧腐蚀。
A.铁作负极,被氧化的电极反应式为Fe–2e-=Fe2+,故A错误;
B.铁腐蚀过程中化学能部分转化为电能,部分转化成其他能量,故B错误;
C.活性炭作正极与铁和氯化钠溶液构成原电池,使铁的腐蚀速率加快,故C正确;
D.铁腐蚀需要由水和氧气,讲氯化钠溶液换成水,铁也能发生吸氧腐蚀,故D错误;
综上所述,答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
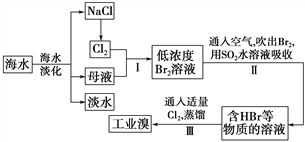
小学生10分钟应用题系列答案【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
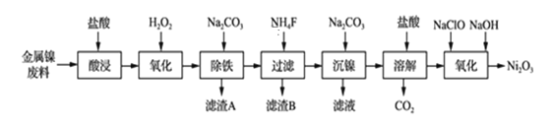
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。
【题目】氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
则△H2=___________。
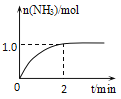
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:

①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
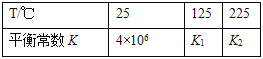
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。