题目内容
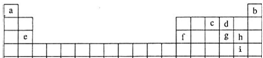
如表是元素周期表的一部分:
(1)表中元素⑩的氢化物的化学式为 的氢化物的还原性
的氢化物的还原性
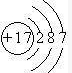
(2)某元素的原子结构示意图为: ,在周期表位于
,在周期表位于
(3)用电子式表示 与⑧形成化合物形成过程:
与⑧形成化合物形成过程:
 .
.
(4)写出⑦与⑨、⑨与 的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:
| 族 |
I A | II A | III A | IV A | V A | VI A | VII A |
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |  |
 |
PH3
PH3
,此氢化物的还原性比元素 的氢化物的还原性
的氢化物的还原性强
强
稳定性弱
弱
(填强或弱)(2)某元素的原子结构示意图为:
 ,在周期表位于
,在周期表位于第三周期第ⅣA族
第三周期第ⅣA族
.该氢化物沸点比甲烷高
高
.(3)用电子式表示
 与⑧形成化合物形成过程:
与⑧形成化合物形成过程:

(4)写出⑦与⑨、⑨与
 的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨:OH-+Al(OH)3═AlO2-+2H2O
OH-+Al(OH)3═AlO2-+2H2O
、⑨与
3H++Al(OH)3═Al3++3H2O
3H++Al(OH)3═Al3++3H2O
.分析:(1)⑩为P, 为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;
为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;
(2)K层电子数最多为2,则x=2,根据原子结构分析其在元素周期表中的位置,气态氢化物的相对分子质量越大,沸点越高;
(3) 为S,⑧为Mg,形成的化合物为离子化合物;
为S,⑧为Mg,形成的化合物为离子化合物;
(4)⑦为Na,⑨为Al, 为Cl,然后利用酸碱之间的反应来分析.
为Cl,然后利用酸碱之间的反应来分析.
 为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;
为S,非金属性越强,则对应离子的还原性越弱,气态氢化物越稳定;(2)K层电子数最多为2,则x=2,根据原子结构分析其在元素周期表中的位置,气态氢化物的相对分子质量越大,沸点越高;
(3)
 为S,⑧为Mg,形成的化合物为离子化合物;
为S,⑧为Mg,形成的化合物为离子化合物;(4)⑦为Na,⑨为Al,
 为Cl,然后利用酸碱之间的反应来分析.
为Cl,然后利用酸碱之间的反应来分析.解答:解:(1)⑩为P,其氢化物的化学式为PH3, 为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;
为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;
(2)K层电子数最多为2,则x=2,则原子结构中有3个电子层,最外层电子数为4,在元素周期表中的位置为第三周期第ⅣA族,气态氢化物的相对分子质量PH3>CH4,则PH3沸点高,
故答案为:第三周期第ⅣA族;高;
(3) 为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为
为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为 ,故答案为:
,故答案为: ;
;
(4)⑦为Na,⑨为Al, 为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,
为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O;3H++Al(OH)3═Al3++3H2O.
 为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;
为S,非金属性S>P,则还原性PH3>H2S,气态氢化物H2S>PH3,故答案为:PH3;强;弱;(2)K层电子数最多为2,则x=2,则原子结构中有3个电子层,最外层电子数为4,在元素周期表中的位置为第三周期第ⅣA族,气态氢化物的相对分子质量PH3>CH4,则PH3沸点高,
故答案为:第三周期第ⅣA族;高;
(3)
 为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为
为S,⑧为Mg,形成的化合物为离子化合物,其形成过程为 ,故答案为:
,故答案为: ;
;(4)⑦为Na,⑨为Al,
 为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,
为Cl,NaOH与Al(OH)3反应的离子反应为OH-+Al(OH)3═AlO2-+2H2O,HClO4与Al(OH)3反应的离子反应为3H++Al(OH)3═Al3++3H2O,故答案为:OH-+Al(OH)3═AlO2-+2H2O;3H++Al(OH)3═Al3++3H2O.
点评:本题考查元素周期表和元素周期律,明确元素在周期表中的位置及元素、单质、化合物的性质即可解答,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目

 它的空间利用率为
它的空间利用率为