题目内容
【题目】升高温度时,化学反应速率加快,主要是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
【答案】B
【解析】
升高温度时,化学反应速率加快,是因升高温度,反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快,而与该反应为吸热反应或放热反应无关,故选B。

练习册系列答案
相关题目
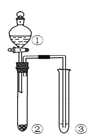
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D