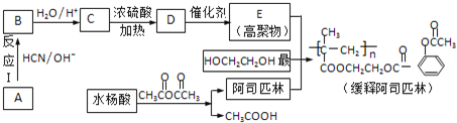
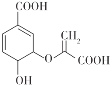
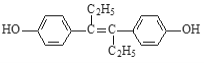
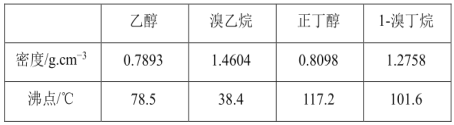
题目内容
【题目】常温下,下列溶液中由水电离的氢离子浓度为1×10-5的是 ( )
A.pH=5的HClO 溶液B.pH=9的氨水
C.pH=5的AlCl3溶液D.pH=5的NaHSO4溶液
【答案】C
【解析】
A. pH=5的HClO 溶液中由酸电离出的c(H+)为10-5mol/L,根据水的离子积计算由水电离出的c(H+);
B. pH=9的氨水中由碱电离出的c(OH-)为10-5 mol/L,根据水的离子积计算由水电离出的c(H+);
C. AlCl3为强酸弱碱盐,Al3+水解使溶液显弱酸性,pH=5的AlCl3溶液中的c(H+)即为由水电离出的c(H+);
D. NaHSO4为强电解质,完全电离后生成Na+、H+和SO42-,根据水的离子积计算由水电离出的c(H+)。
A. pH=5的HClO 溶液中由酸电离出的c(H+)为10-5mol/L,那么由水电离出的c(H+)=由水电离出的c(OH-)=![]() =10-9mol/L,A项错误;
=10-9mol/L,A项错误;
B. pH=9的氨水中由碱电离出的c(OH-)为10-5 mol/L,那么由水电离出的c(H+)=由水电离出的c(H+)=![]() =10-9mol/L,B项错误;
=10-9mol/L,B项错误;
C. AlCl3为强酸弱碱盐,Al3+水解使溶液显弱酸性,pH=5的AlCl3溶液中的c(H+)即为由水电离出的c(H+),因此由水电离出的c(H+)=10-5 mol/L,C项正确;
D. NaHSO4为强电解质,完全电离后生成Na+、H+和SO42-,当溶液的pH=5时,即NaHSO4完全电离生成的H+的浓度为10-5 mol/L,那么由水电离出的c(H+)=由水电离出的c(OH-)=![]() =10-9mol/L,D项错误;
=10-9mol/L,D项错误;
答案选C。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进 Fe2O3的转化,可采取的措施是____(选填序号)
a.用更高效的催化剂 b.粉碎矿石,增大接触面积
c.及时吸收或移出CO2 d.增大反应体系的压强
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.再加入一些铁粉 b.充入一定量CO
c.增大压强 d.升高温度
【题目】A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,相同浓度A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是___,B是___。
(2)写出C与D反应的离子方程式___。
(3)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=___(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___。
(5)在一定体积的0.005mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是___。
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为![]()
![]() ,请回答下列相关问题。
,请回答下列相关问题。
![]() 下表为部分键能数据,据此可算出
下表为部分键能数据,据此可算出![]() ___________
___________![]() 。
。
化学键 |
|
|
|
|
键能 | 332 | 611 | 414 | 436 |
![]() 一定温度下,向
一定温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() 发生脱氢反应,经过
发生脱氢反应,经过![]() 达到平衡状态,测得平衡时气体压强是开始的
达到平衡状态,测得平衡时气体压强是开始的![]() 倍。
倍。
![]() 内氢气的生成速率
内氢气的生成速率![]() _______,
_______,![]() 的平衡转化率为_______。
的平衡转化率为_______。
![]() 下列情况能说明该反应达到平衡状态的是____________
下列情况能说明该反应达到平衡状态的是____________![]() 填标号
填标号![]() 。
。
A.混合气体的平均相对分子质量保持不变 ![]() 与
与![]() 的物质的量之比保持不变
的物质的量之比保持不变
C.混合气体的密度保持不变 ![]() 的分解速率与
的分解速率与![]() 的消耗速率相等
的消耗速率相等
![]() 脱氢反应分别在压强为
脱氢反应分别在压强为![]() 和
和![]() 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
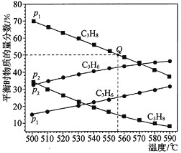
![]() 压强:
压强:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
![]() 若
若![]() ,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数
,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数![]() _______
_______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。