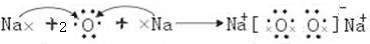题目内容
过氧化氢由于在反应后生成氧气或水,被称为“绿色试剂”.下列反应中过氧化氢只表现还原性的是( )
| A、2KMnO4+5H2O2+3H2SO4=K2S+2MnSO4+5O2↑+8H2O | ||||
| B、H2O2+Cl2=2HCl+O2↑ | ||||
C、2H2O2
| ||||
| D、H2O2+H2S=2H2O+S↓ |
分析:H2O2中O元素化合价为-1价,H2O2在反应中只变现为还原性,则O元素化合价升高,被氧化而生成氧气,结合元素的化合价变化解答该题.
解答:解:A.反应中Mn元素化合价降低,O元素化合价升高,H2O2被氧化,只表现还原性,故A正确;
B.反应中Cl元素化合价降低,O元素化合价升高,H2O2被氧化,只表现还原性,故B正确;
C.反应中O元素化合价既升高又降低,过氧化氢既是氧化剂又是还原剂,故C错误;
D.反应中O元素化合价降低,S元素化合价升高,过氧化氢表现为氧化性,故D错误.
故选AB.
B.反应中Cl元素化合价降低,O元素化合价升高,H2O2被氧化,只表现还原性,故B正确;
C.反应中O元素化合价既升高又降低,过氧化氢既是氧化剂又是还原剂,故C错误;
D.反应中O元素化合价降低,S元素化合价升高,过氧化氢表现为氧化性,故D错误.
故选AB.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识相关概念及相关物质的性质的判断,难度不大.

练习册系列答案
相关题目
(分)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?请你参与他们的探究过程。
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂。
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 |
|
| 实验二 |
| 木条复燃 | Al2O3能加快H2O2溶液的分解速率 |
(3)[结论]:故Al2O3能作H2O2溶液分解的催化剂。
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用。还应补充一个上述反应前后Al2O3质量是否改变的探究实验。
实验三:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行 ;
④ 。
(5)有同学认为,即使实验三中Al2O3在反应前后质量不变,要证明猜想,上述三个实验还不足够,仍需要再增加一个探究Al2O3 。
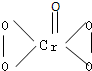
I.在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故.已知过氧化铬的结构简式为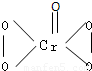 ?
?
(1)CrO5中氧元素的化合价为 .
(2)上述反应的离子方程式为 .
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i元素名称是 .
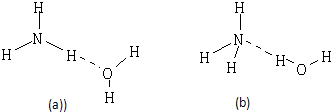
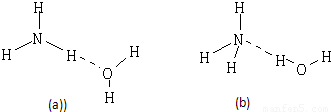
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 .(填序号)
(3)用电子式表示e的过氧化物的形成过程 .
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式: .
 ?
?(1)CrO5中氧元素的化合价为 .
(2)上述反应的离子方程式为 .
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | j | ||||||||||||||||
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 .(填序号)

(3)用电子式表示e的过氧化物的形成过程 .
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式: .
 ?
?