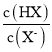题目内容
【题目】电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
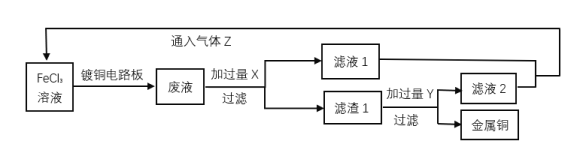
回答下列问题:
(1)过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为___。
(2)滤渣1成分的化学式为___;试剂Y为___。
(3)可替代气体Z的试剂为___(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4)写出FeCl3溶液腐蚀覆铜板的离子方程式___。
(5)用实验证明滤液1中只含有Fe2+___。
【答案】玻璃棒、漏斗 Fe、Cu 盐酸(或HCl) C 2Fe3+ +Cu=2Fe2+ + Cu2+ 取少量滤液1于试管中,先滴加KSCN溶液,不显红色,再滴加氯水后显红色,证明原溶液只含有Fe2+
【解析】
(1)过滤操作需要的仪器为铁架台(附铁圈)、烧杯、滤纸、玻璃棒、漏斗;
(2)滤渣1中含有金属铜与过量的Fe,加入盐酸,过滤,回收铜,据此分析;
(3)滤液2中含有氯化亚铁,与滤液1合并,制备氯化铁,据此进行解答;
(4)FeCl3溶液腐蚀覆铜板是铜与氯化铁反应生成氯化铜、氯化亚铁;
(5)验证Fe2+方法:KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,据此解答。
(1)过滤操作需要的仪器为铁架台(附铁圈)、烧杯、滤纸、玻璃棒、漏斗,
故答案为:玻璃棒、漏斗;
(2)由工艺流程可知,FeCl3溶液与镀铜电路板反应生成的废液中有氯化铜、氯化亚铁;在废液中加入过量的铁单质可得到滤液1(氯化亚铁)和滤渣1(金属铜与过量的Fe),往滤渣1中加入盐酸,过滤,回收得到金属铜和滤液2(氯化亚铁),
故答案为:Fe、Cu;盐酸(或HCl);
(3)滤液2中含有氯化亚铁,与滤液1合并,制备氯化铁,因此气体Z是具有氧化性的氯气, 可替代气体Z的试剂应为过氧化氢,因为氯化亚铁与过氧化氢反应生成氯化铁和水,没有引入新杂质, 而使用硝酸和酸性高锰酸钾会引入新杂质,
故答案为:C;
(4)FeCl3溶液腐蚀覆铜板是铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:2Fe3+ +Cu=2Fe2+ + Cu2+,
故答案为:2Fe3+ +Cu=2Fe2+ + Cu2+;
(5)证明滤液1中只含有Fe2+:可以用KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象的原理来验证,具体实验步骤为:取少量滤液1于试管中,先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液只含有Fe2+,
故答案为:取少量滤液1于试管中,先滴加KSCN溶液,不显红色,再滴加氯水后显红色,证明原溶液只含有Fe2+。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
A.①B.②和④C.③和④D.①和②