题目内容
11.中和热测定实验中,用50mL 0.50mol/L盐酸和50mL 0.55mol/LNaOH进行实验,下列说法不正确的是( )
| A. | 改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比用 50 mL 0.50 mol/L盐酸和50 mL 0.50 mol/L NaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
分析 A.中和热取决于稀的强酸与强碱反应生成1mol水放出的热量,与酸碱的物质的量无关;
B.碱过量可以保证盐酸完全反应,减小测定误差;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
D.中和热测定实验成败的关键是保温工作.
解答 解:A.中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等,故A正确;
B.用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比,后者NaOH溶液过量,可保证盐酸完全反应,测得的数值更准确,故B正确;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T可知测量结果偏低,故C错误;
D.大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,故D正确;
故选C.
点评 本题考查中和热的测定,题目难度不大,明确中和热测定原理及步骤为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
5. 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
3.下列化合物中含有手性碳原子的是( )
| A. | 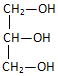 | B. |  | C. | CCl2F2 | D. | H2N-CH2-COOH |
3.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛.它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料.
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
【实验探究】某化学小组选用图1所示部分装置进行实验(部分夹持装置略)
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
①所选用装置的正确连接顺序为ACBD(填装置的字母序号).
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验.
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2,没有SO3.
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500°C\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
(3)已知BaSO3、BaSO4均难溶于水,化学小组利用上述实验分离出的SO2气体,进行与可溶性钡盐溶液反应的探究实验(图2).
①步骤Ⅱ的现象说明实验中产生的白色沉淀是BaSO4(填化学式).
②关于G中有白色沉淀产生的原因,你认为可能是由于装置中的氧气参加了反应.
③写出H中发生反应的离子方程式3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
【实验探究】某化学小组选用图1所示部分装置进行实验(部分夹持装置略)

(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
①所选用装置的正确连接顺序为ACBD(填装置的字母序号).
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验.
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2,没有SO3.
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500°C\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
(3)已知BaSO3、BaSO4均难溶于水,化学小组利用上述实验分离出的SO2气体,进行与可溶性钡盐溶液反应的探究实验(图2).
| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
②关于G中有白色沉淀产生的原因,你认为可能是由于装置中的氧气参加了反应.
③写出H中发生反应的离子方程式3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
20.分子式为C9H10O2,并能与饱和NaHCO3溶液反应放出气体的芳香族化合物有(不考虑立体异构)( )
| A. | 6种 | B. | 14种 | C. | 16种 | D. | 18种 |

 ,X的化学式为Fe3C.
,X的化学式为Fe3C.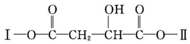 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).

