题目内容
7.氯化亚铁具有独有的脱色能力,广泛用于化学生产.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.甲同学选择如下装置用氯化铁晶体(FeCl3•6H2O)制备少量氯化亚铁.查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.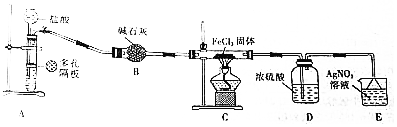
回答下列问题:
(1)利用FeCl3•6H2O制备无水氯化铁的方法是在HCl气流中加热蒸干.
(2)若装置A中选用锌粒制备H2,则该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)装药品之前必须进行的操作是检验装置气密性,实验时先打开A中活塞,过一会儿,点燃C处酒精灯,这样操作的目的是用氢气排尽装置内的空气.
(4)确认C中已发生反应的现象是有呈绿至黄色物质出现;写出C处的化学方程式:2FeCl3+H2=FeCl2+HCl.
(5)为了探究Fe2+的还原性,乙同学设计如下实验:
实验Ⅰ:取少量样品与试管中,滴加酸化的双氧水,再滴加KSCN溶液,溶液变红色;
实验Ⅱ:取少量样品与试管中,滴加酸化的重铬酸钾溶液,溶液由橙红色变成绿色.
经课题组分析、讨论,一致认为上述实验方案不能达到实验目的.请你填写可能原因:
实验Ⅰ:样品中可能含有氯化铁;实验Ⅱ:颜色变化不大,不易观察.
分析 氯化铁晶体(FeCl3•6H2O)制备少量氯化亚铁,流程为:由装置A制备氢气,制得的氢气含有氯化氢杂质和水,用B装置中的碱石灰吸收氯化氢和水蒸气,氢气与氯化铁在C处发生反应生成氯化亚铁和氯化氢气体,在E装置中氯化氢与硝酸银反应生成白色沉淀,因为氯化铁受遇水剧烈水解,故在C与E中加D装置浓硫酸吸收水蒸气,据此分析;
解答 解:(1)FeCl3•6H2O晶体得到无水氯化铁,应防止氯化铁水,需要在在HCl气流中加热蒸干;
故答案为:在HCl气流中加热蒸干;
(2)装置A中用Zn与稀盐酸制取氯气,发生的离子方程式为:Zn+2H+=Zn2++H2↑;
故答案为:Zn+2H+=Zn2++H2↑;
(3)反应中有气体参与,故装药品之前必须进行的操作是检验装置气密性;亚铁离子易被氧化,故实验时先打开A中活塞,过一会儿,用氢气排尽装置内的空气,再点燃C处酒精灯;
故答案为:检验装置气密性;用氢气排尽装置内的空气;
(4)C处为氯化铁与氢气反应生成氯化亚铁和氯化氢的反应,化学方程式为:2FeCl3+H2=FeCl2+HCl,氯化亚铁呈绿至黄色,故C中已发生反应的现象是有呈绿至黄色物质出现;
故答案为:有呈绿至黄色物质出现;2FeCl3+H2=FeCl2+HCl;
(5)样品中可能含有没反应完的氯化铁,能使KSCN显红色,不能确定是亚铁离子被双氧水氧化后的铁离子所致,故实验Ⅰ不能达到实验目的;氯化亚铁与重铬酸钾反应:6FeCl2+K2Cr2O7+14HCl=6FeCl3+2CrCl3+2KCl+7H2O,由于重铬酸钾橙红色,氯化亚铁为呈绿至黄色,而生成物FeCl3为橘黄色,CrCl3为深绿色,所以反应前后颜色不会变化太大,实验Ⅱ不能达到实验目的;
故答案为:样品中可能含有氯化铁;颜色变化不大,不易观察.
点评 本题考查了物质的制备,涉及离子方程式的书写,实验操作的控制,离子的检验,题目难度中等,注意将物质的性质与实际操作联系.

 名校课堂系列答案
名校课堂系列答案| A. | 温度 | B. | 压强 | C. | 分子直径 | D. | 分子个数 |
单质$\stackrel{+O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 硅 | B. | 硫 | C. | 铜 | D. | 铁 |
①绿矾 ②氢氧化铁 ③氯水 ④亚硫酸钠 ⑤过氧化钠.
| A. | 全部 | B. | ②③④ | C. | ①②③ | D. | ①②③⑤ |
| A. | 质量为32g | B. | 含氧原子数为NA | ||
| C. | 含氧分子数为NA | D. | 在标准状况下,体积约为22.4L |
| A. | 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃) |
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在煤油或石蜡油中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |



