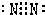题目内容
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 二 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
| 三 | ① | ③ | ④ | ⑧ | ⑩ | |||
| 四 | ② |  |
(2)①③⑦⑨形成的简单离子半径由大到小的顺序为______.
(3)⑦⑧形成的氢化物沸点较高的是______,原因是______.
(4)⑩与
 两元素核电荷之差是______.
两元素核电荷之差是______.(5)⑤的一种氢化物A相对分子质量为16,在A的水合物晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个A分子或水分子,若这8个分子笼中有6个容纳的是A分子,另外2个笼被水分子填充,这种水合物的平均组成可表示为______.
【答案】分析:(1)根据元素周期律:同周期元素的原子从左到右碱性逐渐减弱,同主族从上到下碱性逐渐增强来回答;
(2)核外电子排布一样,核电荷数越多半径越小;
(3)水分子建有氢键导致沸点较高;
(4)元素核电荷之差=原子序数之差,根据同主族元素的原子序数差来回答;
(5)根据题中关于天然气水合物构成的描述,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,推断该天然气水合物的构成中CH4分子与H2O分子的粒子数的比,判断天然气水合物的平均组成的表示式.
解答:解:根据元素在周期表中的位置,可以确定①是Na,②是K,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是S,⑨是F,⑩是Cl,最后一个是Br.
(1)①②③④的最高价氧化物对应水化物分别是:氢氧化钠、氢氧化钾、氢氧化镁、氢氧化铝,同周期元素的原子从左到右碱性逐渐减弱,同主族从上到下碱性逐渐增强,所以碱性强到弱的顺序为:KOH>NaOH>Mg(OH)2>Al(OH)3,故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(2)钠离子、氧离子、镁离子和氟离子的核外电子排布一样,核电荷数越多半径越小,故答案为:O2->F->Na+>Mg2+;
(3)硫和氧元素形成的氢化物分别是硫化氢和水,但是水分子间有氢键导致沸点较高,故答案为:H20;分子间有氢键;
(4)核电荷数等于原子序数,Cl与Br的原子序数之差为18,故答案为:18;
(5)C的氢化物中相对分子质量为16的是甲烷,因为平均每46个水分子构成8个笼,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,所以天然气水合物的构成中含6个CH4分子、46+2=48个H2O分子,则CH4分子与H2O分子粒子数比=6:48=1:8,可判断天然气水合物的平均组成可表示为CH4?8H2O,故答案为:CH4?8H2O.
点评:本题考查学生元素周期表的结构以及元素周期律的相关知识,可以根据所学知识进行回答,综合性较强,难度较大.
(2)核外电子排布一样,核电荷数越多半径越小;
(3)水分子建有氢键导致沸点较高;
(4)元素核电荷之差=原子序数之差,根据同主族元素的原子序数差来回答;
(5)根据题中关于天然气水合物构成的描述,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,推断该天然气水合物的构成中CH4分子与H2O分子的粒子数的比,判断天然气水合物的平均组成的表示式.
解答:解:根据元素在周期表中的位置,可以确定①是Na,②是K,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是S,⑨是F,⑩是Cl,最后一个是Br.
(1)①②③④的最高价氧化物对应水化物分别是:氢氧化钠、氢氧化钾、氢氧化镁、氢氧化铝,同周期元素的原子从左到右碱性逐渐减弱,同主族从上到下碱性逐渐增强,所以碱性强到弱的顺序为:KOH>NaOH>Mg(OH)2>Al(OH)3,故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(2)钠离子、氧离子、镁离子和氟离子的核外电子排布一样,核电荷数越多半径越小,故答案为:O2->F->Na+>Mg2+;
(3)硫和氧元素形成的氢化物分别是硫化氢和水,但是水分子间有氢键导致沸点较高,故答案为:H20;分子间有氢键;
(4)核电荷数等于原子序数,Cl与Br的原子序数之差为18,故答案为:18;
(5)C的氢化物中相对分子质量为16的是甲烷,因为平均每46个水分子构成8个笼,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,所以天然气水合物的构成中含6个CH4分子、46+2=48个H2O分子,则CH4分子与H2O分子粒子数比=6:48=1:8,可判断天然气水合物的平均组成可表示为CH4?8H2O,故答案为:CH4?8H2O.
点评:本题考查学生元素周期表的结构以及元素周期律的相关知识,可以根据所学知识进行回答,综合性较强,难度较大.

练习册系列答案
相关题目