题目内容
下图为常温下用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸的曲线。若以HA表示酸,下列判断和说法正确的是

[ ]
A.图1是滴定盐酸的曲线
B.B、E状态时,两溶液中离子浓度均为c(Na+) = c(A-)
C.C、E状态时,反应消耗的酸n(CH3COOH) = n(HCl)
D.当0 mL<V(NaOH)<20. 00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
B.B、E状态时,两溶液中离子浓度均为c(Na+) = c(A-)
C.C、E状态时,反应消耗的酸n(CH3COOH) = n(HCl)
D.当0 mL<V(NaOH)<20. 00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
BC

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
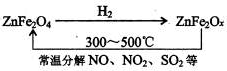
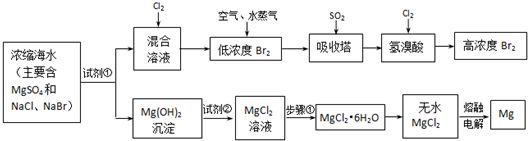
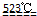 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑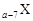 、
、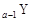 、
、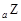 、
、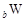 、
、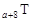 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。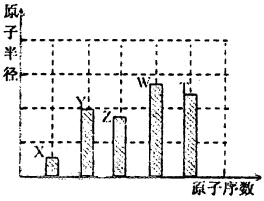
 (4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
(4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题