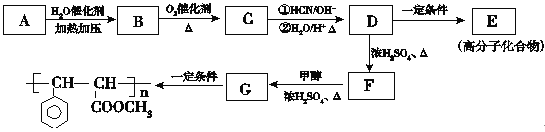
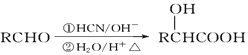题目内容
【题目】下列叙述正确的是![]()
![]() 的溶液一定呈中性
的溶液一定呈中性
![]() 已知
已知![]() ,则含
,则含![]() NaOH的稀溶液与稀醋酸完全中和,放出
NaOH的稀溶液与稀醋酸完全中和,放出![]() 的热量
的热量
![]() 向淀粉溶液中加入稀
向淀粉溶液中加入稀![]() ,加热几分钟,冷却后再加入新制
,加热几分钟,冷却后再加入新制![]() 悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
![]() 同一主族的元素,原子半径越大,其单质的熔点不一定越高
同一主族的元素,原子半径越大,其单质的熔点不一定越高
![]() 乙酸乙酯在NaOH溶液
乙酸乙酯在NaOH溶液![]() 中水解产物为
中水解产物为![]() 和
和![]()
![]() 水的电子式
水的电子式![]() :O:
:O:![]()
A.![]() B.
B.![]() C.
C.![]() D.全部
D.全部
【答案】B
【解析】
![]() 溶液是否呈中性取决于
溶液是否呈中性取决于![]() 、
、![]() 的大小,只要满足
的大小,只要满足![]() ,则溶液呈中性,故正确;
,则溶液呈中性,故正确;
![]() 醋酸为弱酸,电离吸热,则含
醋酸为弱酸,电离吸热,则含![]() NaOH(物质的量为1mol)的稀溶液与稀醋酸完全中和生成1mol水时,放出热量小于
NaOH(物质的量为1mol)的稀溶液与稀醋酸完全中和生成1mol水时,放出热量小于![]() ,故错误;
,故错误;
![]() 淀粉在酸性条件下水解,而葡萄糖与氢氧化铜浊液的反应在碱性条件下进行,水解后应先加入氢氧化钠时溶液变为碱性,故错误;
淀粉在酸性条件下水解,而葡萄糖与氢氧化铜浊液的反应在碱性条件下进行,水解后应先加入氢氧化钠时溶液变为碱性,故错误;
![]() 同一主族的元素,如为金属单质,原子半径越大,故正确;
同一主族的元素,如为金属单质,原子半径越大,故正确;
![]() 乙酸乙酯在氢氧化钠的
乙酸乙酯在氢氧化钠的![]() 中水解生成
中水解生成![]() 和
和![]() ,故正确;
,故正确;
![]() 水为共价化合物,电子式为
水为共价化合物,电子式为![]() ,故错误;
,故错误;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g。
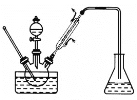
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手_______,右手摇动锥形瓶,眼睛 _____________滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:____________,即到终点,读出体积并记录。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a、滴定管在盛装标准NaOH溶液前未润洗
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c、达到滴定终点时,俯视溶液凹液面最低点读数
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________(结果保留三位小数)。