题目内容
17.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.(1)某青铜器中Sn、Pb的质量分别为23.8g、4.14g,则该青铜器中Sn和Pb原子数目之比为10:1.
(2)采用“局部封存法”可以防止青铜器进一步被腐蚀.如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,则该化学方程式为Ag2O+2CuCl=2AgCl+Cu2O.
分析 (1)根据m=nM来计算Sn、Pb的物质的量之比,根据N=nNA知,物质的量之比等于其个数之比;
(2)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物.
解答 解:(1)Sn、Pb的物质的量之比=$\frac{23.8g}{119g/mol}$:$\frac{4.14g}{207g/mol}$=0.2mol:0.02mol=10:1,根据N=nNA知,物质的量之比等于其个数之比,所以Sn、Pb原子个数之比为10:1,故答案为:10:1;
(2)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,故答案为:Ag2O+2CuCl═2AgCl+Cu2O.
点评 本题考查物质的性质,为高频考点,把握物质的性质、物质的量的计算及发生的反应为解答的关键,侧重分析与实验能力的考查,注意题目中信息的应用,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
7.关于Na2CO3和NaHCO3的下列说法中正确的是( )
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |
8.将固体NH 4I置于密闭容器中,在某温度下发生下列反应:①NH 4I(s)?NH 3(g)+HI(g),②2HI(g)?H 2(g)+I 2(g),当反应达到平衡时,测得c(H 2)=0.5mol/L,c(HI)=4mol/L,则反应①的平衡常数为( )
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
5.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向酸性KMnO4溶液中滴加足量H2O2 | 溶液的紫红色消失 | 双氧水有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某无色溶液中滴加足量稀盐酸 | 产生白色沉淀 | 该无色溶液中一定存在Ag+ |
| A. | A | B. | B | C. | C | D. | D |
12.在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
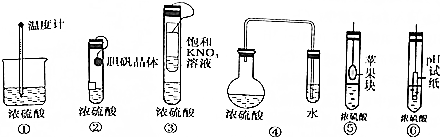

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.生产、生活中离不开各类化学物质,下列化学物质中属于盐类的是( )
| A. | 胆矾 | B. | 金刚石 | C. | 水晶 | D. | 苛性钠 |
9.三氟化氮(NF3)在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列判断正确的是( )
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | 反应中被氧化与被还原的原子物质的量之比为2:1 | |
| C. | 若反应中生成0.2molHNO3,则反应共转移0.4mol电子 | |
| D. | NF3在潮湿空气中泄漏会产生红棕色气体 |
6.位于元素周期表中第三周期ⅥA族的元素是( )
| A. | C | B. | O | C. | Si | D. | S |
7.用pH试纸测定某无色溶液的pH时,规范的操作是( )
| A. | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较 | |
| B. | 将溶液倒在pH试纸上,跟标准比色卡比较 | |
| C. | 将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 | |
| D. | 试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |