题目内容
在密闭容器中充入4mol SO2和 O2,在一定条件下建立平衡:2SO2(g) + O2(g) ? ?2SO3(g) △H,若SO2的转化率为90%,则在此条件下,反应放出的热量为( )
| A.3.6△H | B.1.8△H |
| C.2△H | D.0.9△H |
B
由反应2SO2(g) + O2(g) ? ?2SO3(g) △H
起始物质的量 4mol 3mol 0
变化物质的量 3.6 mol 1.8 mol 3.6 mol
平衡物质的量 0.43.6 mol 1.2 mol 3.6 mol
可逆反应方程式中的反应热为反应物完全转化为生成物时的反应热,在该反应中,每消耗2mol SO2放出的热量为△H,则反应3.6 mol SO2放出的热量为1.8△H;
起始物质的量 4mol 3mol 0
变化物质的量 3.6 mol 1.8 mol 3.6 mol
平衡物质的量 0.43.6 mol 1.2 mol 3.6 mol
可逆反应方程式中的反应热为反应物完全转化为生成物时的反应热,在该反应中,每消耗2mol SO2放出的热量为△H,则反应3.6 mol SO2放出的热量为1.8△H;

练习册系列答案
相关题目
 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
 保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______ 。
保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______ 。 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是:
 2NH3 (g)+ Q,其平衡常数K与温度T的关系如下表:
2NH3 (g)+ Q,其平衡常数K与温度T的关系如下表: N2(g)+
N2(g)+  H2(g)
H2(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是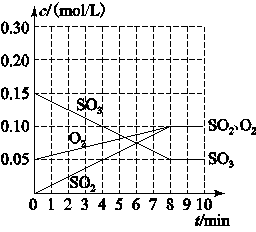
 cC(固)+dD当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡:
cC(固)+dD当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡: