题目内容
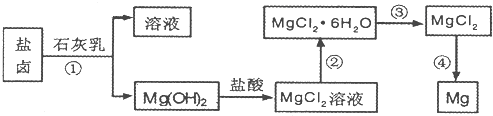
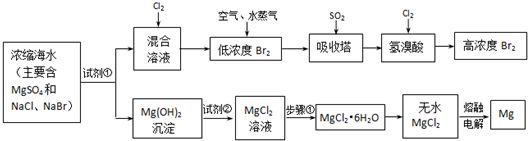
目前世界上60%的镁是从海水中提取的.学生就这个课题展开了讨论.已知海水提镁的主要步骤如下:

(1)关于加入试剂①作沉淀剂,同学们提出了不同方法.请你参与他们的讨论:
| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是:(四) | ||
(二)______;
(三)______;
(四)______.
(2)框中加入的试剂①应该是______(填“化学式”);加入的试剂②是______(填“化学式”);工业上由无水MgCl2制取镁的化学方程式为:______.
解:(1)方法1与其他方法相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生方法1不正确,原因是:海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀;
方法2与其他方法相比,高温蒸发海水,消耗的能源多,成本太高.因此方法2的方法不正确,原因是:能源消耗大,海水的综合利用低,成本高;
应先浓缩海水,然后加入沉淀剂,
故答案为:(一)海水中镁离子浓度小,沉淀剂的用量大,不经济;
(二)不正确;
(三)能源消耗大,不经济;
(四)向太阳光蒸发浓缩后的海水中,加入沉淀剂;
(2)氯化镁生成氢氧化镁,应加入Ca(OH)2或CaO;要使氢氧化镁转化为氯化镁,则需要加入盐酸反应;工业上由无水MgCl2制取镁,常用电解的方法,方程式为MgCl2(融溶) Mg+Cl2↑,
Mg+Cl2↑,
故答案为:Ca(OH)2;HCl;MgCl2(融溶) Mg+Cl2↑.
Mg+Cl2↑.
分析:(1)根据海水中镁离子的浓度以及海水处理的成本进行对比分析,可得出结论;
(2)在浓缩后的海水中加入碱可生成氢氧化镁,然后加入盐酸生成氯化镁,电解熔融的氯化镁可得到镁.
点评:本题以海水的综合应用为载体综合考查物质的分离与提纯,侧重于考查学生化学知识的综合运用能力和评价能力,答题时注意从题目物质转化、化学反应、方法的优劣等来分考问题,通过本题要学会怎样评价不同方法的优劣,从而选择出最佳方法.
方法2与其他方法相比,高温蒸发海水,消耗的能源多,成本太高.因此方法2的方法不正确,原因是:能源消耗大,海水的综合利用低,成本高;
应先浓缩海水,然后加入沉淀剂,
故答案为:(一)海水中镁离子浓度小,沉淀剂的用量大,不经济;
(二)不正确;
(三)能源消耗大,不经济;
(四)向太阳光蒸发浓缩后的海水中,加入沉淀剂;
(2)氯化镁生成氢氧化镁,应加入Ca(OH)2或CaO;要使氢氧化镁转化为氯化镁,则需要加入盐酸反应;工业上由无水MgCl2制取镁,常用电解的方法,方程式为MgCl2(融溶)
 Mg+Cl2↑,
Mg+Cl2↑,故答案为:Ca(OH)2;HCl;MgCl2(融溶)
 Mg+Cl2↑.
Mg+Cl2↑.分析:(1)根据海水中镁离子的浓度以及海水处理的成本进行对比分析,可得出结论;
(2)在浓缩后的海水中加入碱可生成氢氧化镁,然后加入盐酸生成氯化镁,电解熔融的氯化镁可得到镁.
点评:本题以海水的综合应用为载体综合考查物质的分离与提纯,侧重于考查学生化学知识的综合运用能力和评价能力,答题时注意从题目物质转化、化学反应、方法的优劣等来分考问题,通过本题要学会怎样评价不同方法的优劣,从而选择出最佳方法.

练习册系列答案
相关题目

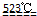 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑