题目内容
 某同学为验证Fe能与热的浓HNO3反应,设计了如上图所示的实验装置,a中加入的是Fe片和浓HNO3,b加入的是NaOH溶液.请你参与研究并回答下列问题:
某同学为验证Fe能与热的浓HNO3反应,设计了如上图所示的实验装置,a中加入的是Fe片和浓HNO3,b加入的是NaOH溶液.请你参与研究并回答下列问题:(1)当该同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时用所得的溶液又进行如下试验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解.Cu片溶解的原因可能是
②请设计实验证明再加入Cu片不再溶解后的溶液中含有Fe2+但不含Fe3+.说明具体操作和实验现象
(2)若研究稀硝酸与铁的反应,要用浓硝酸进行配制.实验室有10mol/L 的硝酸溶液,从中量出5.0mL,其物质的量浓度为
分析:(1)①根据反应后溶液中含有的Fe(NO3)3,稀HNO3能与铜片反应;
②先根据Fe3+的特征反应,加入硫氰酸钾溶液判断溶液不含Fe3+,然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在;
(2)溶液的物质的量浓度是溶液的性质,与体积多少无关;
根据配制溶液的操作步骤判断所用仪器;
根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
②先根据Fe3+的特征反应,加入硫氰酸钾溶液判断溶液不含Fe3+,然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在;
(2)溶液的物质的量浓度是溶液的性质,与体积多少无关;
根据配制溶液的操作步骤判断所用仪器;
根据c=
| n |
| V |
解答:解:(1)①反应后溶液中含有的Fe(NO3)3,稀HNO3能与铜片反应,离子方程式分别为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu+2Fe3+=Cu2++2Fe2+;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu+2Fe3+=Cu2++2Fe2+;
②取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
故答案为:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
(2)实验室有10mol/L 的硝酸溶液,从中量出5.0mL,其物质的量浓度仍然为10mol/L;
量取浓硫酸要用量筒和胶头滴管,稀释浓硫酸要用烧杯、玻璃棒,配制溶液要用100mL容量瓶,定容时要用胶头滴管滴加蒸馏水至液面与刻度线相切,
在配制过程中,定容时仰视,溶液的体积偏大,根据c=
分析可知溶液浓度偏小;
故答案为:10;100mL容量瓶,胶头滴管;偏小;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu+2Fe3+=Cu2++2Fe2+;
②取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
故答案为:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
(2)实验室有10mol/L 的硝酸溶液,从中量出5.0mL,其物质的量浓度仍然为10mol/L;
量取浓硫酸要用量筒和胶头滴管,稀释浓硫酸要用烧杯、玻璃棒,配制溶液要用100mL容量瓶,定容时要用胶头滴管滴加蒸馏水至液面与刻度线相切,
在配制过程中,定容时仰视,溶液的体积偏大,根据c=
| n |
| V |
故答案为:10;100mL容量瓶,胶头滴管;偏小;
点评:本题主要考查了铜的性质、离子的检验以及物质的量浓度的知识,难度不大,再离子检验时注意氧化剂、KSCN溶液的顺序不能颠倒.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题: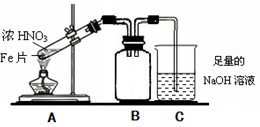
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |

(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②