题目内容
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: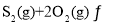
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
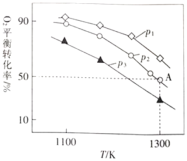
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
【答案】![]() ab
ab ![]() 0.05
0.05 ![]()
![]() >
>![]() >
>![]() ;
; ![]()
【解析】
⑴根据盖斯定律计算焓变。
⑵①根据化学平衡状态的特征进行判断,根据影响平衡移动的因素分析;②根据平衡常数公式及平衡常数不变来分析。
⑶三步走建立关系,再根据压强之比等于物质的量之比计算,再计算S2(g)的反应速率。
⑷①利用温度变化,平衡移动来分析焓变;利用转化率的变化来分析压强变化;②建立三段式,根据压强之比等于物质的量之比计算平衡压强,再根据压强平衡常数进行计算。
⑴根据盖斯定律:第1个方程式的2倍加上第2个方程式的2倍,再加上第3个方程式,因此则![]() 的
的![]()
![]() ;故答案为:
;故答案为:![]() 。
。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①a. 密度等于气体质量除以容器体积,正向反应,气体质量增加,容器体积不变,当气体的密度不变,则反应一定达到了平衡状态,故a正确;b. 该反应只有S2(g)是气体,气体的相对分子质量始终不变,因此反应不一定处于平衡状态,故b正确;c. 增加MoS2的量,MoS2是固体,平衡不移动,故c错误;综上所述,答案为:ab。
②达到平衡时S2(g)的浓度为1.4 mol·L1,充入一定量的S2(g),根据平衡常数公式及平衡常数不变,反应再次达到平衡,S2(g)浓度= 1.4 mol·L1;故答案为:=。
⑶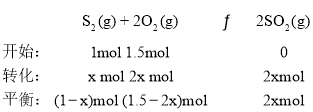 ,根据压强之比等于物质的量之比得到
,根据压强之比等于物质的量之比得到![]() ,得到x = 0.5,则
,得到x = 0.5,则![]() 内,S2(g)的反应速率为
内,S2(g)的反应速率为![]() ;故答案为:0.05。
;故答案为:0.05。
⑷①温度升高,氧气转化率降低,说明平衡逆向移动,逆向是吸热反应,正向是放热反应即ΔH <0;该反应是体积减小的反应,在1300K,从下到上,氧气转化率越来越大,说明是正向移动即加压,因此![]() >
>![]() >
>![]() ;故答案为:
;故答案为:![]() >
>![]() >
>![]() 。
。
② ,根据压强之比等于物质的量之比得到
,根据压强之比等于物质的量之比得到![]() ,P(平衡) = 5.5kPa,则A点平衡常数
,P(平衡) = 5.5kPa,则A点平衡常数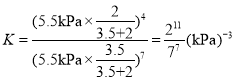 ;故答案为:
;故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案