题目内容
 已知:CO2(g)+3H2(g)
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )
CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )分析:A.根据0~1min以及3~4min单位时间内氢气的物质的量的变化量比较反应速率;
B.平衡时氢气的物质的量为2mol,根据转化率=
×100%计算;
C.H2的物质的量随时间变化曲线与曲线II平衡状态不同;
D.升高温度,反应速率增大,平和向逆反应方向移动.
B.平衡时氢气的物质的量为2mol,根据转化率=
| △n |
| n总 |
C.H2的物质的量随时间变化曲线与曲线II平衡状态不同;
D.升高温度,反应速率增大,平和向逆反应方向移动.
解答:解:A.0~1min氢气的物质的量的变化量为2mol,3~4min内氢气的物质的量的变化量小于1mol,则0~1min的平均反应速率大于3~4min的平均反应速率,故A正确;
B.平衡时氢气的物质的量为2mol,转化率=
×100%=
×100%=75%,故B正确;
C.H2的物质的量随时间变化曲线与曲线II平衡状态不同,且曲线II反应速率小,应是减小压强或降低温度,故C错误;
D.升高温度,反应速率增大,平和向逆反应方向移动,曲线I反应速率较大,且氢气的转化率较低,应是升高温度的缘故,故D正确.
故选C.
B.平衡时氢气的物质的量为2mol,转化率=
| △n |
| n总 |
| 6mol |
| 8mol |
C.H2的物质的量随时间变化曲线与曲线II平衡状态不同,且曲线II反应速率小,应是减小压强或降低温度,故C错误;
D.升高温度,反应速率增大,平和向逆反应方向移动,曲线I反应速率较大,且氢气的转化率较低,应是升高温度的缘故,故D正确.
故选C.
点评:本体考查化学平衡图象问题,题目难度较大,本题注意分析图象中氢气的物质的量的变化,结合反应的特点判断外界条件对平衡移动的影响.

练习册系列答案
相关题目
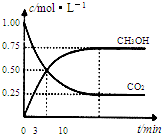 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )| A、0~3min内,v(CO2)正=v (CH3OH)正 | B、其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 | C、在T1℃时,若起始时向容器中充入2molCO2和6mol H2,测得平衡时容器内压强为P2,则 P2<2P1 | D、T2℃时,上述反应平衡常数为4.2,则T2>T1 |
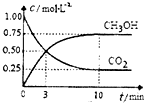 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.OkJ?mol-1 一定条件下,向体积为11的密闭容器中充入lmolCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.OkJ?mol-1 一定条件下,向体积为11的密闭容器中充入lmolCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中正确的是( )| A、升高温度平衡常数K增大 | B、反应达到平衡状态时,CO2的平衡转化率为75% | C、3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | D、从反应开始到平衡,H2的平均反应速率v (H2)=0.075mol?L-1?min-1 |
 (2010?揭阳二模)已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
(2010?揭阳二模)已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )