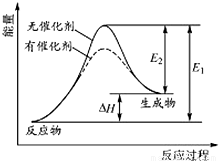
题目内容
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个热化学方程式: .
(2)家用液化气中的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,则丁烷的标准燃烧热△H= .已知1mol液态水汽化时需要吸收44kJ的热量,则反应:C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)的△H= kJ?mol-1.
(2)家用液化气中的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,则丁烷的标准燃烧热△H=
| 13 | 2 |
分析:(1)依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变;
(2)燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,依据盖斯定律结合热化学方程式计算得到所求反应的焓变.
(2)燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,依据盖斯定律结合热化学方程式计算得到所求反应的焓变.
解答:解:(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290 kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1;
(2)当10kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,1mol丁烷燃烧生成二氧化碳和液态水放出热量=
=2900kJ;
所以丁烷的标准燃烧热△H=-2900 kJ?mol-1 ;
C4H10(g)+
O2(g)═4CO2(g)+5H2O(l)△H=-2900 kJ?mol-1 ;
H2O(l)═H2O(g)△H=+44kJ/mol,
依据盖斯定律计算得到C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)的△H=-2680kJ/mol;
故答案为:-2900 kJ?mol-1;-2680.
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ?mol-1;
(2)当10kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,1mol丁烷燃烧生成二氧化碳和液态水放出热量=
| 58g×5×105kJ |
| 10×103g |
所以丁烷的标准燃烧热△H=-2900 kJ?mol-1 ;
C4H10(g)+
| 13 |
| 2 |
H2O(l)═H2O(g)△H=+44kJ/mol,
依据盖斯定律计算得到C4H10(g)+
| 13 |
| 2 |
故答案为:-2900 kJ?mol-1;-2680.
点评:本题考查了热化学方程式书写方法和注意问题,燃烧热概念,盖斯定律计算的应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.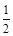 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1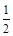 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1