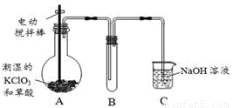
题目内容
已知:①在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝;②在上述蓝色溶液中,滴加过量的Na2SO3溶液,蓝色逐渐消失;③取实验②生成的溶液滴加BaCl2溶液有白色沉淀生成.下列判断正确的是
- A.上述实验证明氧化性:ClO->I2>SO42-
- B.上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3
- C.实验①中硫酸的作用是氧化性和酸性
- D.实验②证明SO32-既有氧化性又有还原性
分析:A、根据①、②中的反应方程式判断ClO-、I2、SO42-的氧化性强弱;
B、根据②溶液中存在的阴离子判断沉淀的成分;
C、根据反应方程式判断硫酸的作用;
D、根据②中SO32-的化合价变化判断其性质.
解答:A、①中的反应方程式NaClO+2KI+H2SO4=I2+NaCl+K2SO4+H2O,ClO-的氧化性大于I2的氧化性;
②中的反应方程式Na2SO3+I2+H2O=Na2SO4+2HI,I2 的氧化性大于SO4 2-的氧化性;
所以氧化性强弱为:ClO->I2>SO42-,故A正确;
B、②中滴加过量的Na2SO3溶液,所以溶液中有Na2SO3和Na2SO4,Na2SO3与Na2SO4和BaCl2反应都生成白色沉淀,故B错误;
C、、①中的反应方程式NaClO+2KI+H2SO4=I2+NaCl+K2SO4+H2O,H2SO4反应前后各元素的化合价都没变化,所以硫酸的作用是酸性,故C错误;
D、②中的反应方程式Na2SO3+I2+H2O=Na2SO4+2HI,Na2SO3失电子作还原剂,具有还原性,故D错误;
故选A.
点评:本题考查了氧化性、还原性强弱的比较,同时考查学生的比较、辨别能力、氧化性、还原性的强弱与得失电子的难易程度有关,与得失电子的多少无关.

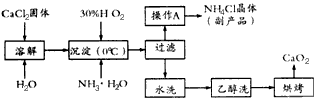
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为 。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为 (已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是 ,吸收塔中吸收剂X的作用是 。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3=Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为 。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是 。
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为 。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为 (已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是 ,吸收塔中吸收剂X的作用是 。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3= Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为 。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是 。
(15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
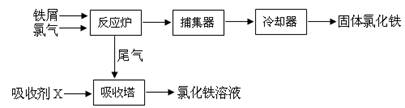
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为 。
(2)已知FeCl3·6H2O在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为 。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为 (已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是 ,吸收塔中吸收剂X的作用是 。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3= Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为 。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是 。