题目内容
甲、乙、丙三种元素的原子序数如表中所示.
(1)填写下表:
(2)写出以上三种元素单质间反应的化学方程式:
甲与乙: ,
乙与丙: .
(1)填写下表:
| 元素 | 甲 | 乙 | 丙 |
| 原子序数 | 6 | 8 | 13 |
| 元素符号 | |||
| 周期 | |||
| 族 |
甲与乙:
乙与丙:
考点:原子结构与元素的性质,元素周期表的结构及其应用
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:(1)原子序数为6的C元素,原子序数为8的为O元素,原子序数为13的为Al元素,结合原子结构中,电子层数=周期数、最外层电子数=族序数分析;
(2)C与氧气反应生成二氧化碳,Al与氧气反应生成氧化铝.
(2)C与氧气反应生成二氧化碳,Al与氧气反应生成氧化铝.
解答:
解:(1)原子序数为6的C元素,原子结构为 ,位于第二周期第ⅣA族;
,位于第二周期第ⅣA族;
原子序数为8的为O元素,原子结构为 ,位于第二周期第ⅥA族,
,位于第二周期第ⅥA族,
原子序数为13的为Al元素,原子结构为 ,位于第三周期第ⅢA族,
,位于第三周期第ⅢA族,
故答案为:
;
(2)C与氧气反应生成二氧化碳,反应为C+O2
CO2,Al与氧气反应生成氧化铝,反应为4Al+3O2
2Al2O3,故答案为:C+O2
CO2;4Al+3O2
2Al2O3.
 ,位于第二周期第ⅣA族;
,位于第二周期第ⅣA族;原子序数为8的为O元素,原子结构为
 ,位于第二周期第ⅥA族,
,位于第二周期第ⅥA族,原子序数为13的为Al元素,原子结构为
 ,位于第三周期第ⅢA族,
,位于第三周期第ⅢA族,故答案为:
| 元素 | 甲 | 乙 | 丙 |
| 原子序数 | 6 | 8 | 13 |
| 元素符号 | C | O | Al |
| 周期 | 二 | 二 | 三 |
| 族 | ⅣA | ⅥA | ⅢA |
(2)C与氧气反应生成二氧化碳,反应为C+O2
| ||
| ||
| ||
| ||
点评:本题考查原子结构与元素的性质,为高频考点,把握原子结构与元素在周期表中位置的关系为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
常温下,向4支试管中各加入3mL 5%的H2O2溶液,分别进行下列实验,关于实验现象的叙述正确的是( )
| A、将试管置于40℃水中,试管中无明显变化 |
| B、将试管置于5℃水中,试管中气泡明显增多 |
| C、向试管中加入少量MnO2,试管中气泡明显增多 |
| D、向试管中加入少量1mol/LFeCl3溶液,试管中无明显变化 |
在硝酸中能大量共存的离子组是( )
| A、Fe2+、Cl- |
| B、Na+、HCO3- |
| C、K+、CO32- |
| D、NH4+、Cl- |

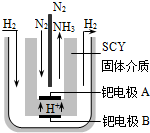 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.

 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.