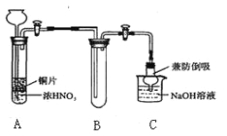
��Ŀ����
����Ŀ��Zn(OH)2�����ڰ�ˮ����[Zn(NH3)4]2+: Zn(OH)2+4NH3��H2O=Zn(NH3)4]2++4H2O+2OH-
��1��ԭ��������ZnԪ��С1��Ԫ�ط���Ϊ____����Ԫ��ԭ�ӻ�̬��������Ų�ʽΪ______��
��2��NH3��H2O�ķе������ͬ��Ԫ���⻯��ķе㣬����Ϊ________��
��3��NH3��Nԭ�ӹ�����ӻ�������______��
��4����H2O���ӻ�Ϊ�ȵ�����ķ���Ϊ_____��
��5����п����һ����Ȼ�纬ZnԪ�صĿ���侧��ṹ�����������壨����ͼ��ʾ������������ZnS����ṹ��S2-����λ��Ϊ________��Zn2+�ķ�������Ϊ��l/4,l/4,l/4������3/4, 3/4,l/4������3/4��l/4,3/4������1/4,3/4,3/4������S2-�ķ�������Ϊ______��

���𰸡� Cu 1s22s22p6 3s23p63d104s1(��[Ar]3d104s1) NH3��H2O�����ڷ��Ӽ���� sp3�ӻ� H2S 4 ��0��0��0������1/2��1/2��0������1/2��0��1/2������0��1/2��1/2����
����������1����Ԫ�����ڱ�֪п��30��Ԫ�أ���ԭ������С1��ΪCuԪ�أ������Ų�ʽΪ1s22s22p6 3s23p63d104s1(��[Ar]3d104s1)��
��2�����Ӿ����۷е�����Է���������������ߣ�NH3��H2O���ӵķе����ͬ��Ԫ���⻯����ΪNH3��H2O�����ڷ��Ӽ������
��3��NH3��Nԭ�������5���ӣ�Hԭ��1���ӣ����ݼ۲���ӶԻ������ۼ۲���Ӷ���=��5+3��/2=4��VSEPRģ�Ϳ�֪Ϊ�������幹�ͣ�SP3�ӻ���
��4���ȵ�����ԭ������ȣ��۵�������ȣ�ΪH2S��
��5��ZnS��Zn2+��S2-��λ����ͬ��1��S2-��Χ��4��Zn2+����λ��Ϊ4���˸�����S2-������ͬΪ��0��0��0�������ĵ�������ͬ���ֱ�Ϊ��1/2��1/2��0������1/2��0��1/2������0��1/2��1/2����