题目内容
(13分)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下图: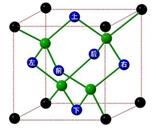
(1)一个水分子含_____个孤电子对,水分子能与很多金属离子形成配合物,请写出它与铜离子形成的一种蓝色的配合物离子的化学式为__________。
(2)每个冰晶胞平均占有____个水分子,冰的熔点远低于金刚石熔点的原因是__________________。
(3)实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键_________(填全部或部分)被破坏。
(4)假如冰晶胞边长为a cm,则冰的密度是________________g·cm-3
(阿伏伽德罗常数用NA表示)。
(1) 2 (2分) [Cu(H2O)4]2+(2分)
(2)8(2分);破坏的作用力不同,金刚石融化需要破坏共价键,而冰融化需要破坏氢键(和分子间作用力)(2分)
部分(2分)
144/a3NA (3分)
解析试题分析:(1)水分子中O原子最外层含有2个未成对电子,还有2个孤电子对;铜离子形成配合物时的配位数为4,则配合物离子的化学式为;[Cu(H2O)4]2+。
(2)根据晶胞示意图,可知H2O分子位置:顶点为8个,面心为6个,晶胞内有4个,根据均摊法,每个冰晶胞平均含有水分子数为:8×1/8+6×1/2+4=8;冰晶体中水分子间作用力为氢键,金刚石晶体中C原子间作用力为化学键,化学键的作用远远大于氢键,所以冰的熔点远低于金刚石熔点。
(3)冰中氢键的作用能为18.5kJ?mol-1,而冰熔化热为5.0kJ?mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,液态水中仍在氢键。
(4)以1个冰晶胞为研究对象,冰的密度=8×18÷NA÷a3=144/a3NA。
考点:本题考查分子与配合物结构、晶胞的结构及计算、熔点的比较。

 单元期中期末卷系列答案
单元期中期末卷系列答案下列有关化学键与晶体结构的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定含有阳离子 |
下列物质中既含有离子键又含有共价键的是
| A.H2O | B.CaCl2 | C.NaOH | D.Cl2 |
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①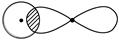
_________________________________________________________________。
②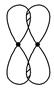
_________________________________________________________________。
③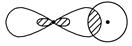
_________________________________________________________________。
④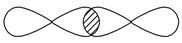
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
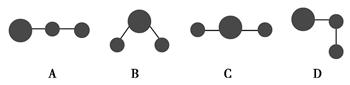
在乙烷(CH3—CH3)、乙烯(CH2=CH2)、乙炔(CH≡CH)分子中的碳碳键键长大小顺序为__________________________________。BCl3分子中Cl—B—Cl键角为__________,HgCl2分子中的键角为____________。
(3)金属键可以看成是由许多原子共用许多电子形成的,所以有人将金属键视为一种特殊形式的共价键。金属键与共价键的明显区别是①________________、②________________。
下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6 |
| C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |