题目内容
15.下列方程式中,属于水解反应的是( )| A. | HCOOH+H2O?HCOO-+H3O+ | B. | H2CO3+H2O?HCO3-+H3O+ | ||
| C. | CO32-+H2O?HCO3-+OH- | D. | HS-+H2O?S2-+H3O+ |
分析 弱酸根离子、弱碱离子与水电离的氢离子、氢氧根离子结合生成弱电解质的反应,为水解反应,以此来解答.
解答 解:A.HCOOH+H2O?HCOO-+H3O+为HCOOH的电离方程式,所以不属于水解反应,故A错误;
B.H2CO3+H2O?HCO3-+H3O+为碳酸的电离方程式,所以不属于水解反应,故B错误;
C.CO32-+H2O?HCO3-+OH-为碳酸根离子的水解反应,故C正确;
D.HS-+H2O?S2-+H3O+为HS-的电离方程式,所以不属于水解反应,故D错误;
故选C.
点评 本题考查了盐的水解反应、离子反应方程式的书写,把握盐类水解及离子反应的书写方法为解答的关键,侧重水解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
5.下列各组物质间,不能发生反应的是( )
| A. | 二氧化硅与氧化钙(高温) | B. | 二氧化硅与氢氧化钠(常温) | ||
| C. | 二氧化硅与碳(高温) | D. | 二氧化硅与浓HNO3(常温) |
10.下列事实一定能说明HF是弱酸的是( )
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
| A. | ①② | B. | ③⑤ | C. | ④⑥ | D. | ②④ |
20.25℃时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )
| A. | SO42-、Na+、HCO3- | B. | CO32-、K+、Na+ | C. | Na+、SO42-、C1- | D. | NH4+、Fe3+、C1- |
7.下列关于水的说法错误的是( )
| A. | 蒸馏法是海水淡化的方法之一 | |
| B. | 长期饮用纯净水,可能会引起一些微量元素的缺乏 | |
| C. | 含有细菌的水可以用臭氧杀菌 | |
| D. | 含有重金属离子的废水用可以用明矾处理 |
4.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.1 mol/(L•min) | B. | v(NH3)=0.2 mol/(L•min) | ||
| C. | v(H2)=0.3 mol/(L•min) | D. | v(H2)=0.4 mol/(L•min) |
8.下列指定反应的离子方程式正确的是( )
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 解饱和NaCl饱和溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
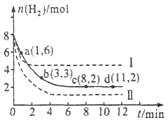 工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
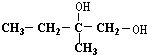 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2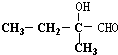 +2H2O.
+2H2O. $→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.
$→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.