题目内容
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
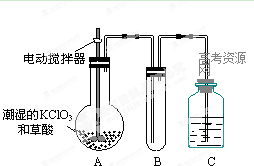
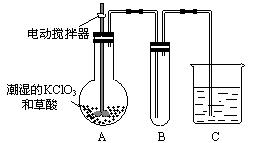
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为 。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
(1)ClO2 Cl2 Na2FeO4(1分);
(2)①2KClO3+H2C2O2=K2CO3+2ClO2↑+CO2↑+H2O(2分) 盛有冰水混合物的水槽(1分)
②C(1分);仪器C没有使瓶内外压强相等,气体不能顺利通过。(1分)
③2ClO2+2OH-= ClO2-+ClO3-+H2O(1分) 80.0(2分)
500ml容量瓶(1分) 烧杯 (1分)
【解析】
试题分析:(1)ClO2中Cl元素由+4价降低为-1价,1molClO2转移5mol电子,消毒效率可表示为:5/67.5mol/g,1molNa2FeO4转移3mol电子,消毒效率可表示为:3/166mol/g,1molCl2转移2mol电子,消毒效率可表示为:2/71mol/g,由大到小的顺序为:ClO2>Cl2>Na2FeO4。
(2)①KClO3把H2C2O2氧化为CO2,根据还原剂与氧化剂的物质的量之比为1:2,可写出化学方程式;因为ClO2的沸点为11.0℃,极易挥发,所以应加盛有冰水混合物的水槽冷却,使ClO2冷凝为液体。
②C部分的试剂瓶塞上了橡皮塞,会造成瓶内外压强不相等,气体不能顺利通过,故C装置设计不合理。
③NaOH吸收ClO2生成HClO3和NaClO2,根据原子守恒,还有H2O生成,配平可得离子方程式;配制450mlNaOH溶液需要500ml容量瓶,NaOH的质量为:0.5L×4mol/L×40g/mol=80.0g,有效数字应与托盘天平的读数对应;溶质需要在烧杯中溶解,仪器还缺烧杯。
考点:本题考查氧化还原反应的计算、化学方程式和离子方程式的书写、化学实验基本仪器和基本操作。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.