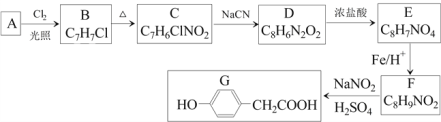
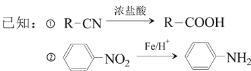
题目内容
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是
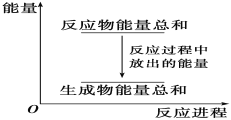
A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
【答案】C
【解析】
A、Zn+H2SO4═ZnSO4+H2↑为放热反应,反应物的总能量大于生成物的总能量,故A正确;
B、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故B正确;
C、氢气在正极产生,故C错误;
D、若设计为原电池,外电路负极有电流流入,电子流出,故D正确。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】下表数据是对应物质的熔点:
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
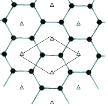
(1)上述涉及原子中最活泼非金属原子核外电子排布式是________________;某阴离子的轨道表示式为![]() ,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
(2)物质①的电子式:____________,⑦的结构式:_______________。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因_______________________________;若把其溶液加热蒸干并灼烧,得到的固体是_______________。
(4)不能用于比较Na与Al金属性相对强弱的事实是_________________。
A.最高价氧化物对应水化物的碱性 B.Na最外层1个电子而Al 最外层3个电子
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(5)⑧比⑦熔点高出很多,其理由是:_____________________________;①和②都属于离子晶体,但①比②的熔点高,请解释原因____________________________。