题目内容
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )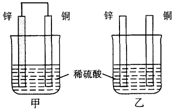
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;
故选C.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
相关题目
20.关于下列图示装置的描述中,不正确的是( )
| A. | 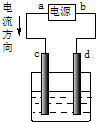 c为阳极,d为阴极 | |
| B. |  用于实验室蒸馏石油 | |
| C. | 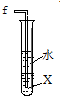 X为CCl4时,可用于吸收氯化氢气体,并防止倒吸 | |
| D. | 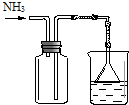 用于收集氨气及并进行尾气吸收 |
1.镁和盐酸反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中可加入( )
| A. | NaCl溶液 | B. | NaNO3溶液 | C. | Na2CO3溶液 | D. | CuSO4溶液 |
18.X、Y、Z、R是中学化学常见的4种主族元素,原子序数依次增大.Y在周期表前20号元素中原子半径最大;X、Y可以形成YX型离子化合物,且离子核外电子数相等;Z、R可以形成共价分子RZ,两原子最外层均达到8电子结构,R显+1价.回答下列问题:
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
乙同学分析后认为:用甲同学的实验设计比较R、Z的非金属性不够严谨,你认为他的理由可能是实验I结束后Cl2可能剩余.
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
| 序号 | 实验内容 | 实验现象 | 用离子方程式解释现象 |
| 实验Ⅰ | 向YZ的水溶液中,加入少许CCl4,逐滴滴加X单质的水溶液,振荡. | CCl4层颜色变成橙红色 | 发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2. |
| 实验Ⅱ | 向上述溶液中加入少量YR的水溶液,振荡. | CCl4层颜色变成紫红色 | 发生反应的离子方程式是Br2+2I-=2Br-+I 2. |
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
5.下列各组给定原子序数的元素,能形成原子数之比为1:1稳定化合物的是( )
①6和8、②7和8、③8和12、④12和17、⑤20和35.
①6和8、②7和8、③8和12、④12和17、⑤20和35.
| A. | ①②③ | B. | ①②④ | C. | ②③⑤ | D. | ③④⑤ |
15.为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
(1)请在下表中填写与实验步骤对应的实验现象序号:
(2)写出钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(3)该实验得出的结论是Na、Mg、Al的金属活动性顺序由强到弱.
(4)用原子结构理论解释上述实验结论:同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小(填“增大”或“减小”),原子核对核外电子的引力逐渐增强,失电子能力逐渐减弱(填“增强”或“减弱”),因此金属性逐渐减弱(填“增强”或“减弱”).
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液 3.将一小段镁带投入稀盐酸中 4.将一小片铝投入稀盐酸中 |
| 实验现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)该实验得出的结论是Na、Mg、Al的金属活动性顺序由强到弱.
(4)用原子结构理论解释上述实验结论:同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小(填“增大”或“减小”),原子核对核外电子的引力逐渐增强,失电子能力逐渐减弱(填“增强”或“减弱”),因此金属性逐渐减弱(填“增强”或“减弱”).
2.根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题.
(1)在周期表中,最可能处于同一族的是D
A.Q和R B.S和T C.T和U D.R和U
(2)它们的氯化物的化学式,最可能正确的是B
A.QCl2 B.RCl C.SCl3 D.UCl4
(3)下列元素中,化学性质和物理性质最像T元素的是A
A.硼(1s22s22p1) B.铍(1s22s2)C.锂(1s22s1)D.氦(1s2)
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和U
(2)它们的氯化物的化学式,最可能正确的是B
A.QCl2 B.RCl C.SCl3 D.UCl4
(3)下列元素中,化学性质和物理性质最像T元素的是A
A.硼(1s22s22p1) B.铍(1s22s2)C.锂(1s22s1)D.氦(1s2)
19.含硒(Se)的保健品已开始进入市场.已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )
| A. | 原子序数为34 | B. | 氢化物比HBr稳定 | ||
| C. | 非金属性比硫强 | D. | 最高价氧化物的水化物显碱性 |

 ;G的结构简式HCOOCH3;
;G的结构简式HCOOCH3; .写出D与C反应生成A的化学方程式CH3OH+
.写出D与C反应生成A的化学方程式CH3OH+ +H2O.
+H2O.