题目内容
使 的 作用,称为离子键. 原子之间容易形成离子键.离子化合物中阴、阳离子可以按一定的方式在空间有规则地排列,形成有一定几何外形的 晶体.
考点:离子化合物的结构特征与性质,离子晶体
专题:化学键与晶体结构
分析:阴、阳离子间的静电作用称为离子键,活泼金属和活泼非金属元素之间的原子易形成离子键,离子化合物形成离子晶体.
解答:
解:阴、阳离子间的静电作用称为离子键,静电作用包含吸引力和排斥力;活泼金属和活泼非金属元素之间的原子易形成离子键,二者通过得失电子形成离子键,离子化合物形成离子晶体,离子晶体是由阴阳离子构成的,故答案为:阴阳离子之间;相互;活泼金属和活泼非金属;离子.
点评:本题考查了离子键的形成、离子化合物的构成微粒等知识点,
注意:(1)阴、阳离子间的静电作用不能单纯地理解为静电引力,而是包括引力和斥力两个方面;当阴、阳离子相距较远时,相互间的引力起主导作用,而当其距离靠近时,斥力逐渐增大,直至距离缩短到一定的程度,斥力与引力平衡,于是就形成了离子键.阴、阳离子间的斥力主要来自两个方面:一是电子与电子之间;二是原子核与原子核之间;
(2)阴、阳离子是形成离子键必不可少的微粒,缺一不可;
(3)一般情况下,活泼金属与活泼非金属间形成离子键;少数非金属间亦能形成离子键,如NH4Cl等铵盐.
注意:(1)阴、阳离子间的静电作用不能单纯地理解为静电引力,而是包括引力和斥力两个方面;当阴、阳离子相距较远时,相互间的引力起主导作用,而当其距离靠近时,斥力逐渐增大,直至距离缩短到一定的程度,斥力与引力平衡,于是就形成了离子键.阴、阳离子间的斥力主要来自两个方面:一是电子与电子之间;二是原子核与原子核之间;
(2)阴、阳离子是形成离子键必不可少的微粒,缺一不可;
(3)一般情况下,活泼金属与活泼非金属间形成离子键;少数非金属间亦能形成离子键,如NH4Cl等铵盐.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、一定条件下,1mol N2和3mol H2充分反应,生成物中的N-H键数目为6NA |
| B、1L 0.1mol?L-1的Na2S的溶液中S2-与HS-的总数为0.1NA |
| C、向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时,该反应转移电子的数目至少为3NA |
| D、1L 0.5mol?L-1 (NH4)2SO4溶液中NH4+数目为NA |
下列试剂中能将硫酸钠、石灰石、二氧化硅这三种白色粉末鉴别开来的是( )
| A、NaOH溶液 | B、水 |
| C、硫酸 | D、盐酸 |

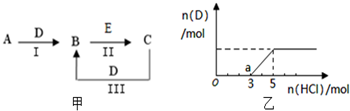 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示 铝是日常生活中用途最多的金属元素,如图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝做
铝是日常生活中用途最多的金属元素,如图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝做