题目内容
12.已知钾的氧化物有K2O2和KO2,在两种化合物组成的混合物中,钾与氧的质量比为13:8,求混合物中K2O2和KO2的物质的量之比.分析 根据n=$\frac{m}{M}$计算K原子、O原子物质的量之比,设K2O2和KO2的物质的量分别为xmol、ymol,根据K原子、O原子数目之比列方程,整理可得二者物质的量之比.
解答 解:钾与氧的质量比为13:8,则K原子、O原子物质的量之比为$\frac{13}{39}$:$\frac{8}{16}$=2:3,设K2O2和KO2的物质的量分别为xmol、ymol,则(2x+y):(2x+2y)=2:3,整理可得x:y=1:2,
答:混合物中K2O2和KO2的物质的量之比为1:2.
点评 本题考查混合物有关计算,比较基础,侧重对物质的量的考查,也可以利用十字交叉法计算.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
2.下列操作中,能使水的电离平衡H2O?H++OH-向右移动且溶液呈酸性的是( )
| A. | 向水中加入KHSO4溶液 | B. | 向水中加入AlCl3溶液 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 将水加热到100℃,使pH=6 |
3.下列对有机物C6H12O2结构的猜测不正确的是( )
| A. | 分子中可能含有一个醛基、一个羟基 | |
| B. | 分子中可能含有一个碳碳双键、两个羟基 | |
| C. | 六个碳原子可能连成环状 | |
| D. | 分子中可能含有一个羧基、一个碳碳双键 |
20.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )
| A. | 升高温度,A2转化率增大 | |
| B. | 升高温度有利于速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
17.原子核内的质子数决定了微粒的( )
| A. | 质量数 | B. | 核外电子数 | C. | 核电荷数 | D. | 核内中子数 |
6.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2-3.8(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4,.

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
7.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图,下列有关氢氧燃料电池的说法不正确的是( )
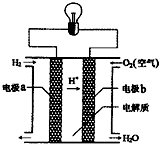

| A. | a电极是负极 | |
| B. | 该电池的总反应:2H2+O2═2H2O | |
| C. | 产物为无污染的水,属于环境友好电池 | |
| D. | 外电路中电子b电极通过导线流向a电极 |
