题目内容
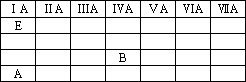
元素周期表前20号元素中有A、B、C、D、E五种元素.已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同主族,A与C、B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1∶4.
(1)写出元素符号:A________、B________、E________.
(2)若A和C能以原子数1∶1形成一种化合物,写出该化合物的化学式:________.
答案:
解析:
提示:
解析:
|
答案:(1)K Si H (2)K2O2 思路分析:A、B原子最外层电子数之比为1∶4,它们都不是稀有气体元素,则A、B原子最外层电子数分别为1和4,进而可知A在元素周期表的ⅠA族,B在元素周期表的ⅣA族.E与A同族,则E也在ⅠA族.A、B、C、D、E都是元素周期表前20号元素,第20号元素位于元素周期表的第4周期、ⅡA族.A与C、B与E原子的电子层数都相差2,D比C的原子半径小,则C、D都在第2周期且C的原子序数小于D.
|
提示:
|
考查元素周期律与元素周期表的综合应用. |

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目