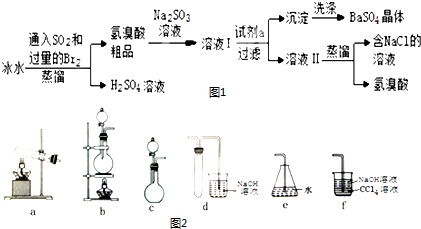
题目内容
下列几种类推结论中,错误的是( )
①钠和水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
③铁露置在空气中一段时间后就会生锈;性质更活泼的铝露置在空气中也很容易腐蚀
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应;SiO2也不与所有的酸反应
⑤密度为1.4 g/cm3的H2SO4溶液与密度为1.8g/cm3的硫酸等体积混合后,所得H2SO4溶液的密度介于1.4g/cm3与1.8g/cm3之间;Na-K合金的熔点应介于Na和K的熔点之间.
①钠和水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
③铁露置在空气中一段时间后就会生锈;性质更活泼的铝露置在空气中也很容易腐蚀
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应;SiO2也不与所有的酸反应
⑤密度为1.4 g/cm3的H2SO4溶液与密度为1.8g/cm3的硫酸等体积混合后,所得H2SO4溶液的密度介于1.4g/cm3与1.8g/cm3之间;Na-K合金的熔点应介于Na和K的熔点之间.
| A、①③⑤ | B、②④ |
| C、①③④⑤ | D、①②③④⑤ |
考点:钠的化学性质,二氧化硫的化学性质,浓硫酸的性质,钠的重要化合物,铁的化学性质
专题:元素及其化合物
分析:①活泼金属可以和水反应生成碱和氢气;
②含有钠元素的物质焰色反应均为黄色;
③金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成氧化铝的保护膜;
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应,SiO2与氢氟酸反应;
⑤合金的熔点会低于任一组成金属成分的熔点.
②含有钠元素的物质焰色反应均为黄色;
③金属铁在空气中因发生电化学腐蚀而生锈,金属铝和氧气反应生成氧化铝的保护膜;
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应,SiO2与氢氟酸反应;
⑤合金的熔点会低于任一组成金属成分的熔点.
解答:
解:①活泼金属钠与水反应生成NaOH和H2,但是金属活动顺序表金属铝以后的金属均和水不反应,故①错误;
②含有钠元素的物质NaCl、Na2CO3焰色反应均为黄色,故②正确;
③铁露置在空气中一段时间后就会生锈,是因为发生电化学腐蚀而生锈,金属铝在空气中和氧气反应生成氧化铝的保护膜,使铝不易被腐蚀,故③错误;
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应,氢氟酸(HF)可用来在玻璃(主要成分:SiO2)上雕刻各种精美图案,反应为:4HF+SiO2═SiF4↑+2H2O,故④错误;
⑤NaK合金的熔点应低于Na和K任一金属的熔点,故⑤错误.
故选C.
②含有钠元素的物质NaCl、Na2CO3焰色反应均为黄色,故②正确;
③铁露置在空气中一段时间后就会生锈,是因为发生电化学腐蚀而生锈,金属铝在空气中和氧气反应生成氧化铝的保护膜,使铝不易被腐蚀,故③错误;
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应,氢氟酸(HF)可用来在玻璃(主要成分:SiO2)上雕刻各种精美图案,反应为:4HF+SiO2═SiF4↑+2H2O,故④错误;
⑤NaK合金的熔点应低于Na和K任一金属的熔点,故⑤错误.
故选C.
点评:本题考查类推这一思维方法在化学学科中的应用,属于方法与知识相结合的内容,是高考的热点之一.

练习册系列答案
相关题目
下列物质在空气中不能被酒精灯点燃的是( )
| A、钠块 | B、镁条 | C、铝箔 | D、硫粉 |
下列溶液中离子一定能够大量共存的是( )
| A、加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
| B、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
| C、c(H+):c(OH-)=1:1012的水溶液中:CO32-、Na+、NO3-、AlO2- |
| D、无色溶液中:K+、Na+、MnO4-、SO42- |
用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
| A、滴定前滴定管中有气泡,滴定后消失 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时俯视读数 |
| D、锥形瓶取用NaOH待测液前加少量水洗涤 |

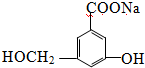
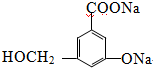
 .
.