题目内容
11.现有九种物质(1)铝线(2)石墨(3)氯气(4)硫酸镁晶体(5)无水乙酸(6)金刚石(7)石灰水(8)乙醇(9)熔融的硝酸钾其中能导电的是(1)(2)(7)(9);
属于电解质的是(4)(5)(9);
既不是电解质也不是非电解质的是(1)(2)(3)(6)(7).
乙酸的电离方程式是CH3COOH?CH3COO-+H+
乙酸钠水解的离子方程式是CH3COO-+H2O?CH3COOH+OH-.
分析 物质导电的条件:含有自由电子或者自由移动的离子;
电解质在水溶液或熔化状态下能够导电的化合物;
非电解质在水溶液和熔化状态下都不能够导电的化合物;
单质、混合物既不是电解质,也不是非电解质;
乙酸为弱酸,部分电离,用可逆号;
乙酸钠为强碱弱酸盐,水解生成醋酸和氢氧化钠.
解答 解:(1)铝线金属单质,能导电,既不是电解质也不是非电解质;
(2)石墨是非金属单质,能导电,既不是电解质也不是非电解质;
(3)氯气是非金属单质,含有自由电子或者自由移动的离子,不能导电,既不是电解质也不是非电解质;
(4)硫酸镁晶体不能导电,在水溶液中能导电,是化合物,是电解质;
(5)无水乙酸不能导电,在水溶液中能导电,是化合物,是电解质;
(6)金刚石是非金属单质,不含有自由电子或者自由移动的离子,不能导电,既不是电解质也不是非电解质;
(7)石灰水是混合物,含自由移动的离子能导电,既不是电解质也不是非电解质;
(8)乙醇不能导电,在水溶液或熔融状态下都不能导电,是非电解质;
(9)熔融的硝酸钾,含自由移动的离子能导电,是电解质;
所以:其中能导电的是(1)(2)(7)(9);
属于电解质的是(4)(5)(9);
既不是电解质也不是非电解质的是(1)(2)(3)(6)(7).
乙酸为弱酸,部分电离,电离方程式:CH3COOH?CH3COO-+H+;
乙酸钠为强碱弱酸盐,水解生成醋酸和氢氧化钠,离子方程式:CH3COO-+H2O?CH3COOH+OH-;
故答案为:(1)(2)(7)(9);4)(5)(9);(1)(2)(3)(6)(7);
CH3COOH?CH3COO-+H+;
CH3COO-+H2O?CH3COOH+OH-;
点评 本题考查了电解质、非电解质的判断,电离方程式、盐类水解方程式的书写,明确电解质概念及电离方式是解题关键,题目难度不大.

| A. | K+、MnO4-、Na+、Cl- | B. | Na+、NO3-、H+、SO42- | ||
| C. | K+、NO3-、Na+、CO32- | D. | Na+、HCO3-、Cl-、SO42- |
| A. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- | |
| C. | 0.lmol•L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| D. | 向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)═2Fe( OH)3(s)+3Mg2+(aq) |

其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)Na2SO3+H2O2=Na2SO4+H2O.
H2O2可以看作是一种很弱的酸,写出其电离方程式:H2O2?H++HO2-.
(3)该黄铁矿石中硫元素的质量分数为$\frac{32m{\;}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号)
a.简单离子的半径Y>Z b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.
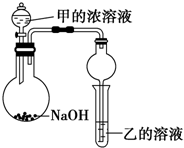
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是把浓氨水滴到NaOH固体上,NaOH固体可吸收水,并且溶液中OH-浓度增大,可使平衡NH3+H2O?NH3•H2O?NH4++OH-向左移动,且过程中放热,故有利于NH3放出.一段时间后,观察到试管中的现象是生成白色沉淀,发生反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.

