题目内容
在给定条件下,下列划线物质在化学反应中能被完全消耗的是
- A.用30ml12mol/L浓盐酸与8.7g二氧化锰共热制取氯气
- B.标况下,将2.7g铝片投入到20ml18mol/L的浓硫酸中
- C.向100ml3mol/L的盐酸中加入5.6g铁
- D.向含Ba(OH)2和NaOH各0.1mol的混合溶液中通入标准状况下2.8LCO2气体
C
分析:A、稀盐酸与二氧化锰不反应;
B、Al与浓硫酸在常温下发生钝化反应;
C、铁与盐酸能反应,根据物质的量及反应来分析;
D、利用n=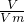 计算二氧化碳的气体,再反应的先后顺序及CO2+2OH-═CO32-+H20及来分析.
计算二氧化碳的气体,再反应的先后顺序及CO2+2OH-═CO32-+H20及来分析.
解答:A、浓盐酸与二氧化锰在加热时发生氧化还原反应,但随反应的进行,浓盐酸变为稀盐酸,而稀盐酸与二氧化锰不反应,则盐酸不会被完全消耗,故A错误;
B、18mol/L的浓硫酸在标况下能与Al发生钝化,生成的致密氧化物薄膜阻止反应的进一下发生,则Al不会被完全反应掉,故B错误;
C、n(Fe)=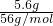 =0.1mol,n(HCl)=0.1L×3mol/L=0.3mol,由Fe+2HCl═FeCl2+H2↑可知,铁在化学反应中能被完全消耗,故C正确;
=0.1mol,n(HCl)=0.1L×3mol/L=0.3mol,由Fe+2HCl═FeCl2+H2↑可知,铁在化学反应中能被完全消耗,故C正确;
D、n(CO2)=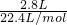 =0.125mol,先发生CO2+Ba(OH)2═BaCO3↓+H20,消耗掉0.1molCO2,
=0.125mol,先发生CO2+Ba(OH)2═BaCO3↓+H20,消耗掉0.1molCO2,
再发生CO2+2OH-═CO32-+H20,则NaOH在反应中不会被完全消耗,故D错误;
故选C.
点评:本题考查物质的性质及相关的化学反应,学生应学会利用反应物的物质的量来判断反应物的消耗,D项是学生解答的难点,应注意反应的先后顺序来解答.
分析:A、稀盐酸与二氧化锰不反应;
B、Al与浓硫酸在常温下发生钝化反应;
C、铁与盐酸能反应,根据物质的量及反应来分析;
D、利用n=
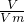 计算二氧化碳的气体,再反应的先后顺序及CO2+2OH-═CO32-+H20及来分析.
计算二氧化碳的气体,再反应的先后顺序及CO2+2OH-═CO32-+H20及来分析.解答:A、浓盐酸与二氧化锰在加热时发生氧化还原反应,但随反应的进行,浓盐酸变为稀盐酸,而稀盐酸与二氧化锰不反应,则盐酸不会被完全消耗,故A错误;
B、18mol/L的浓硫酸在标况下能与Al发生钝化,生成的致密氧化物薄膜阻止反应的进一下发生,则Al不会被完全反应掉,故B错误;
C、n(Fe)=
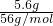 =0.1mol,n(HCl)=0.1L×3mol/L=0.3mol,由Fe+2HCl═FeCl2+H2↑可知,铁在化学反应中能被完全消耗,故C正确;
=0.1mol,n(HCl)=0.1L×3mol/L=0.3mol,由Fe+2HCl═FeCl2+H2↑可知,铁在化学反应中能被完全消耗,故C正确;D、n(CO2)=
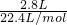 =0.125mol,先发生CO2+Ba(OH)2═BaCO3↓+H20,消耗掉0.1molCO2,
=0.125mol,先发生CO2+Ba(OH)2═BaCO3↓+H20,消耗掉0.1molCO2,再发生CO2+2OH-═CO32-+H20,则NaOH在反应中不会被完全消耗,故D错误;
故选C.
点评:本题考查物质的性质及相关的化学反应,学生应学会利用反应物的物质的量来判断反应物的消耗,D项是学生解答的难点,应注意反应的先后顺序来解答.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
|
在给定条件下,下列划横线的物质在对应的化学反应中能完全耗尽的是 | |
| [ ] | |
A. |
标准状况下,将1 g铝片投入20 mL 18.4 mol/L的硫酸中 |
B. |
向100 mL 5 mol/L的硝酸中加入5.6 g铁 |
C. |
用40 mL 10 mol/L的盐酸与10 g二氧化锰共热制取氯气 |
D. |
在高温高压和有催化剂的条件下,用1.2 mol氮气和3 mol氢气合成氨 |
在给定条件下,下列划横线的物质在对应的化学反应中能完全耗尽的是
| A.标准状况下,将1 g铝片投入20 mL 18.4 mol/L的硫酸中 |
| B.向100 mL 5 mol/L的硝酸中加入5.6 g铁 |
| C.用40 mL 10 mol/L的盐酸与10 g二氧化锰共热制取氯气 |
| D.在高温高压和有催化剂的条件下,用1.2 mol氮气和3 mol氢气合成氨 |