题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能溶液Al2O3的溶液:Na+、K+、HCO—3、NO—3 |
| B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I—、Cl— |
| C.能使甲基橙显红色的溶液:K+、Fe2+、Cl—、NO—3 |
| D.加入KSCN显红色的溶液:Na+、Mg2+、Cl—、SO2—4 |
D
解析试题分析:A、能溶液Al2O3的溶液为强碱性或强酸性溶液,HCO—3均不能大量共存,错误;B、ClO-具有强氧性与I—发生氧化还原反应而不能大量共存,错误;C、能使甲基橙显红色的溶液为酸性溶液,Fe2+、与NO—发生氧化还原反应而不能大量共存,错误;D、正确。
考点:考查离子大量共存有关问题。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| B.明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=A1O2-+2BaSO4+2H2O |
| C.向硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O |
| D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
下列物质仅能在水溶液中导电的是
| A.HCl | B.NaHSO3 | C.NaOH | D.CH3CH2OH |
已知同温度下溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2++2HCO3-+2Ca2++4OH- = Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S = CuS↓+2H+ |
| C.Zn2++S2-+2H2O = Zn(OH)2↓+H2S↑ |
| D.FeS+2H+ = Fe2++H2 S↑ |
 、
、 、
、 和X四种离子以物质的量之比
和X四种离子以物质的量之比  大量共存于同一溶液中,则X
大量共存于同一溶液中,则X
可能是( )
A. | B. | C. | D.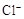 |
下列离子方程式正确的是
| A.钠和冷水反应: Na+2H2O=Na++2OH-+H2↑ |
| B.AlCl3溶液中加入过量的浓氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+ |
C.用小苏打治疗胃酸过多:CO +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
下列反应的离子方程式书写正确的是
| A.向NaClO溶液中通入过量SO2:C1O-+SO2+H2O=HC1O+HSO3- |
| B.用FeCl3蚀刻铜制线路板:Fe3++Cu=Fe2+ +Cu2+ |
| C.向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ +HCO3-+OH-=CaCO3↓ +H2O |
| D.向澄清石灰水中通入过量CO2:CO2+OH-==HCO3- |
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种。取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示。下列判断正确的是
| A.原溶液中可能含有NH4+、SO42- |
| B.最终溶液中最少含2种溶质 |
| C.原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D.滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
在水溶液中能大量共存的一组是
| A.Ba2+、Na+、SO42-、Cl- | B.MnO4-、SO32-、H+、K+ |
| C.AlO2-、Mg2+、K+、HCO3- | D.K+、Na+、NO3-、SO42- |