题目内容
Na2Cr2O7的水溶液存在下列平衡:Cr2O![]() +H2O
+H2O![]() 2HCrO
2HCrO![]() HCrO
HCrO![]()
![]() H++CrO
H++CrO![]()
已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示。为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100 ℃以上蒸发收缩;⑤加稀H2SO4酸化。
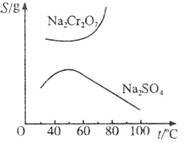
(1)操作步骤的正确顺序是(填序号)____________________________。
(2)用稀H2SO4酸化的目的是__________________________________________。
(3)趁热过滤的目的是__________________________________________。
(1)③ ⑤ ④ ① ② (2)增大c(H+),使HCrO![]()
![]() H++CrO
H++CrO![]() 平衡向左移动,防止生成Na2CrO4 (3)因Na2SO4的溶解度随温度升高而减小,所以趁热过滤便于滤出较多的Na2SO4晶体
平衡向左移动,防止生成Na2CrO4 (3)因Na2SO4的溶解度随温度升高而减小,所以趁热过滤便于滤出较多的Na2SO4晶体
解析:由于Na2Cr2O7溶液中存在水解平衡,若要利用结晶法提纯Na2Cr2O7,应在酸性溶液中进行,原因是增大c(H+)有利于平衡向生成Cr2O![]() 的方向移动。
的方向移动。

练习册系列答案
相关题目
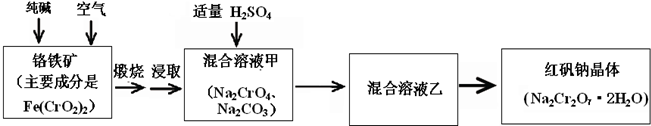




 ,
, .已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。
.已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。