题目内容
(10分)
某同学在用稀硫酸与锌粒(黄豆粒大小)制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有
、 、 。
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
请完成此实验设计,其中:V1= ,V6= ,V9= ;
|
实 验 混合溶液
|
A
|
B
|
C
|
D
|
E
|
F
|
|
|
4mol/LH2SO4/mL
|
40 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
|
CuSO4/mL |
0 |
1 |
5 |
10 |
V6 |
40 |
|
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
15 |
0 |
该同学最后得出的结论为:当加入少量 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。
溶液超过一定量时,生成氢气的速率反而会下降。
(1)Zn+H2SO4=ZnSO4+H2 ↑ Zn+CuSO4=ZnSO4+Cu
(2)Zn与CuSO4溶液反应置换出Cu, Zn、Cu、H2SO4构成原电池,加快反应速率。
(3)加热;适当增大硫酸的浓度;将锌粒改成锌粉,增大接触面积等 (合理即可)
(4)V1 = 40,V6 = 25,V9 = 35
【解析】

(10分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________________
____________________ _;
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________ ;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________。
(12分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 、 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有 、 (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
|
|
A |
B |
C |
D |
E |
F |
|
4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
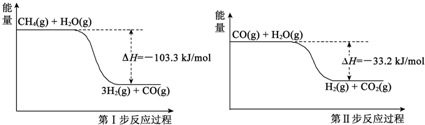 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.