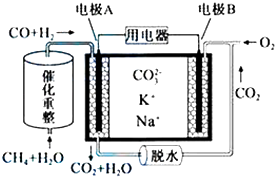
题目内容
【题目】红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
(2)PCl5分解成 PCl3和Cl2的热化学方程式是
(3)P和Cl2分两步反应生成1molPCl5的△H3= P和Cl2一步反应生成1molPCl5的△H4 △H3(填“大于”、“小于”或“等于”).
(4)PCl5 与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是 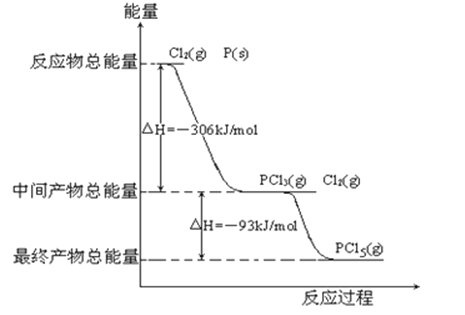
【答案】P(s)+![]() Cl2(g)═PCl3(g)△H=﹣306kJ?mol﹣1;PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol﹣1;﹣399kJ?mol﹣1;等于;PCl5+4H2O═H3PO4+5HCl
Cl2(g)═PCl3(g)△H=﹣306kJ?mol﹣1;PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol﹣1;﹣399kJ?mol﹣1;等于;PCl5+4H2O═H3PO4+5HCl
【解析】(1)根据图示可知:P(s)+![]() Cl2(g)═PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=﹣306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)═PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=﹣306 kJ/mol,则热化学方程式为:P(s)+![]() Cl2(g)═PCl3(g)△H=﹣306 kJ/mol,
Cl2(g)═PCl3(g)△H=﹣306 kJ/mol,
所以答案是:P(s)+![]() Cl2(g)═PCl3(g)△H=﹣306kJmol﹣1;
Cl2(g)═PCl3(g)△H=﹣306kJmol﹣1;
(2)根据图示可知:Cl2(g)+PCl3(g)═PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量﹣反应物总能量=﹣93 kJ/mol;所以PCl5(g)═PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93 kJ/mol,
所以答案是:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol﹣1;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
P(s)+32Cl2(g)═PCl3(g)△H1=﹣306 kJ/mol,
Cl2(g)+PCl3(g)═PCl5(g)△H2=﹣93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=﹣306 kJ/mol+(﹣93 kJ/mol)=﹣399 kJ/mol,
由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=﹣306kJ/mol﹣(+93kJ/mol)=399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
所以答案是:﹣399kJmol﹣1;等于;
(5)PCl5与足量水充分反应,最终生成两种酸:磷酸和盐酸,由原子守恒可知化学方程式为PCl5+4H2O═H3PO4+5HCl,
所以答案是:PCl5+4H2O═H3PO4+5HCl.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案