题目内容
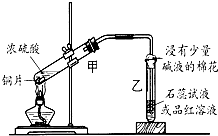 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.(1)若试管乙中装的是石蕊试液,则反应过程中观察到乙中的现象是
石蕊试液变红
石蕊试液变红
;若试管乙中装的是品红溶液,则反应过程中观察到乙中的现象是品红溶液褪色
品红溶液褪色
.(2)反应结束后在试管甲的底部常可见到一些白色固体,该固体可能是
CuSO4
CuSO4
(填化学式).待试管甲内液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色.这一步操作的目的是要证实溶液中有Cu2+ 存在
溶液中有Cu2+ 存在
.(3)写出上述试管甲中发生反应的化学方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
,若收集到标准状况下气体0.56L,则反应中转移电子的物质的量为
| ||
0.05 mol
0.05 mol
.分析:在加热条件下铜与浓硫酸发生:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
(1)二氧化硫为酸性气体,可使石蕊试液变红,具有漂白性,可使品红褪色;
(2)白色固体为CuSO4,溶于水溶液呈蓝色;
(3)根据反应的化学方程式计算转移电子的物质的量.
| ||
(1)二氧化硫为酸性气体,可使石蕊试液变红,具有漂白性,可使品红褪色;
(2)白色固体为CuSO4,溶于水溶液呈蓝色;
(3)根据反应的化学方程式计算转移电子的物质的量.
解答:解:在加热条件下铜与浓硫酸发生:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
(1)二氧化硫为酸性气体,与水反应生成H2SO3,溶液呈酸性,可使石蕊试液变红,具有漂白性,可使品红褪色,
故答案为:石蕊试液变红;品红溶液褪色;
(2)反应生成CuSO4,为白色固体,溶于水溶液呈蓝色,为Cu2+的颜色,故答案为:CuSO4;溶液中有Cu2+存在;
(3)反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,n(SO2)=
=0.025mol,
则转移的电子的物质的量为2×0.025mol=0.05mol,
故答案为:0.05mol.
| ||
(1)二氧化硫为酸性气体,与水反应生成H2SO3,溶液呈酸性,可使石蕊试液变红,具有漂白性,可使品红褪色,
故答案为:石蕊试液变红;品红溶液褪色;
(2)反应生成CuSO4,为白色固体,溶于水溶液呈蓝色,为Cu2+的颜色,故答案为:CuSO4;溶液中有Cu2+存在;
(3)反应的化学方程式为Cu+2H2SO4(浓)
| ||
| 0.56L |
| 22.4L/mol |
则转移的电子的物质的量为2×0.025mol=0.05mol,
故答案为:0.05mol.
点评:本题考查硫酸与铜反应的知识,题目难度不大,注意该反应的化学方程式,为解答该题的重要问题,注意从化合价的变化的角度计算电子的物质的量.

练习册系列答案
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
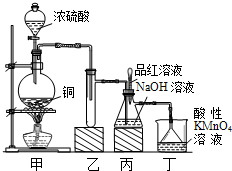 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
