题目内容
【题目】某探究小组的同学用50mL ![]() 溶液与
溶液与![]() KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
KOH溶液按图示装置进行中和反应,并根据反应放出的热量计算反应热。下列说法中错误的是
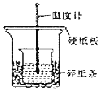
A.两烧杯口应在同一高度,烧杯间应填满碎纸条以减少热量损失
B.为使酸和碱充分混合,图中实验装置应加上环形玻璃搅拌棒和碎纸条
C.实验时![]() 溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
溶液与KOH溶液需一次性混合,还需测量混合液温度的最高值
D.若换成![]() 溶液与该KOH溶液反应,放出的热量相等
溶液与该KOH溶液反应,放出的热量相等
【答案】D
【解析】
解:A、两烧杯口在同一高度时,反应容器内热量损失较少,而且两烧杯间能够填充更多碎纸条,保温效果更好,故A正确;
B、图中缺少环形玻璃搅拌棒,并且填满碎纸条使两烧杯口在同一高度,保温效果会更好,故B正确;
C、酸碱一次性混合比多次混合更能减少热量损失,混合液的温度先升后降,需记录最高值,故C正确;
D、换成60mL![]()
![]()
![]() 溶液时,与原实验相比,中和热不变,但生成水的物质的量增加,放出的热量也会增加,故D错误;
溶液时,与原实验相比,中和热不变,但生成水的物质的量增加,放出的热量也会增加,故D错误;
故选:D。

 优加精卷系列答案
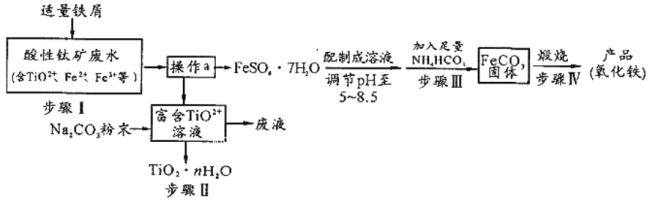
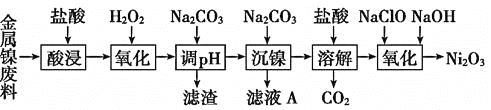
优加精卷系列答案【题目】三氧化二镍![]() 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料![]() 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质![]() ,继而生产
,继而生产![]() 的工艺流程如下:
的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 ![]() 搅拌
搅拌 ![]() 减少盐酸的浓度
减少盐酸的浓度 ![]() 将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入![]() 的目的:__________。沉镍前需加
的目的:__________。沉镍前需加![]() 控制溶液pH范围为______,所得到滤渣的主要成分是_______。
控制溶液pH范围为______,所得到滤渣的主要成分是_______。
(3)从滤液A中可回收利用的主要物质是![]() 和________。
和________。
(4)“氧化”生成![]() 的离子方程式为__________________________。
的离子方程式为__________________________。
(5)工业上用镍为阳极,电解![]() 溶液与一定量
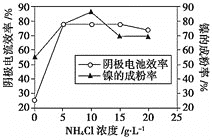
溶液与一定量![]() 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,![]() 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则![]() 的浓度最好控制为_________。
的浓度最好控制为_________。