题目内容
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是 ,俗称 。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为 。
(1)NaHCO3;小苏打 (2)HCO3- + H+= H2O + CO2↑;=
(3)2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
解析试题分析:1)碳酸氢钠的化学式是NaHCO3,俗称小苏打。
(2)碳酸氢钠能和氢离子反应,所以碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为HCO3- + H+= H2O + CO2↑;根据碳酸氢钠和碳酸钠的化学式NaHCO3、Na2CO3并依据碳原子守恒可知,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者=后者。
(3)碳酸氢钠稳定性差,受热易分解生成碳酸钠、水和CO2,所以除去碳酸钠固体中碳酸氢钠的方法是加热,反应的化学化学方程式为2NaHCO3 Na2CO3 + H2O + CO2↑。
Na2CO3 + H2O + CO2↑。
考点:考查碳酸氢钠的性质、用途、俗名、物质的分离与提纯、碳酸钠、碳酸氢钠与盐酸反应的计算、方程式的书写等
点评:该题是基础性试题的考查,难度不大。主要是考查学生对碳酸氢钠性质、用途等则知识的熟悉了解程度,意在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的规范答题能力。

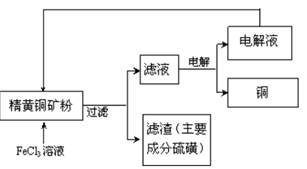
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
提出假设
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
设计实验方案验证假设
该小组对燃烧后的白色产物
进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| | ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是 。
(2)乙同学认为方案2得到的结论正确,白色物质为 。
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(4)钠在二氧化碳中燃烧的化学方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点?并简述理由: 。
 k+s-5#
k+s-5# NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:





 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1