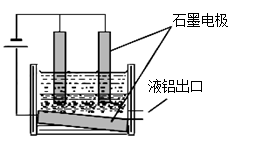
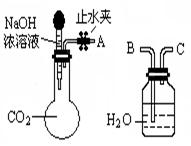
题目内容
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品:
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-):____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+______。
(1)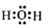
(2)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(3)Fe2O3+2KNO3+4KOH  2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
(4)①淀粉 溶液由蓝色变为无色且半分钟不变色 ②5.6 偏高
(5)取溶液1少量于试管中,加入盐酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+。或去少量溶液1于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+。
解析试题分析:
(2)酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。
(3)缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平。
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点;②由Fe3+~S2O32-得n(Fe3+)=0.002mol,铁元素总含量为5.6g/L;H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。
(5)检验溶液中的Fe3+可用KSCN溶液。检验溶液中的Fe2+可用酸性高锰酸钾溶液或K3[Fe(CN)]6溶液。
考点: 电子式 离子方程式 缺项配平 化学实验

用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):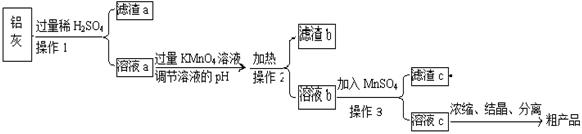
(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整: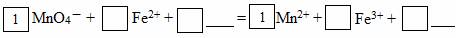
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
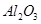 ,含
,含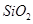 、
、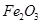 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: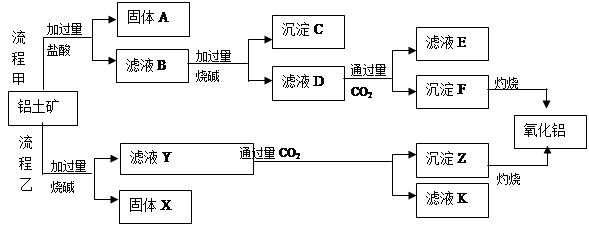
 的溶度积常数
的溶度积常数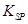 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
 4AlCl3+3O2
4AlCl3+3O2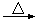 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。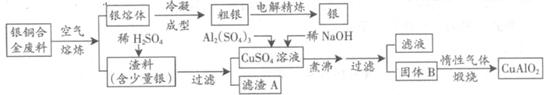
 CuAlO2 + ↑。
CuAlO2 + ↑。