题目内容
A、B、C三种元素,已知A、B同主族,B、C同周期,A的气态氢化物分子式为H2A,其中含氢11.11%;B与A可直接化合,产生两种化合物,其中B与A的质量比分别为:1∶1和2∶3;4.6 g C元素单质可与3.2 g A单质化合生成C2A2;A、B元素原子核内的质子数和中子数相等,C元素原子核内中子数比质子数多1.计算确定,A、B、C各是什么元素?写出一个A与B、A与C形成的化合物之间的反应方程式.
答案:
解析:
解析:
| 解析:从H2A中含H 11.11%计算得出A的相对原子质量为16,A为氧.该A、B化合物为BO2、BO3可计算出B的相对原子质量为16(不合题意)、32,可知B为S.含3.2 g氧的C2O2的物质的量是0.1 mol,可知C的相对原子质量是23,C是Na.
答案:A:氧元素 B:硫元素 C:钠元素 Na2O+SO2====Na2SO3
|

练习册系列答案
相关题目
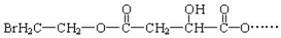
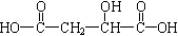 ,
,

 ,
,
