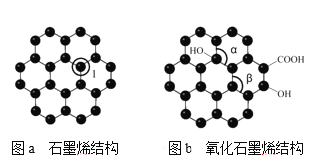
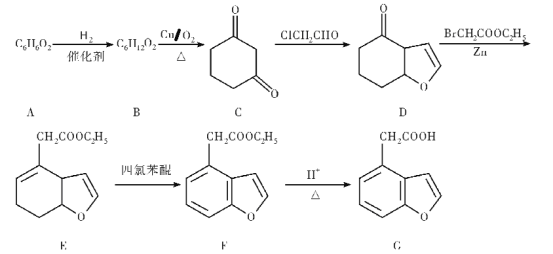
��Ŀ����
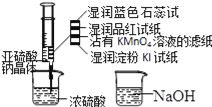
����Ŀ��ij100mL��Һ���ܺ��� Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵����ȷ����
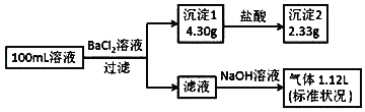
A. ��ԭ��Һ�в����� Na+���� c��Cl������0.1molL��1
B. ԭ��Һ���ܴ��� Cl�� �� Na+
C. ԭ��Һ�� c��CO32������ 0.01molL��1
D. ԭ��Һһ������ CO32����SO42����һ�������� Fe3+
���𰸡�D
��������
����BaCl2��Һ֮���г������ɣ��Ҽ����������֮�����������٣���˵��һ����CO32����SO42�����������ӣ�һ��û��Fe3+��Fe3+��CO32���ᷢ��˫ˮ�ⷴӦ�����ܹ��棩���ҳ���2ΪBaSO4��n(BaSO4)=![]() ��m(BaCO3)=4.30g-2.33g=1.97g����n(BaCO3)=
��m(BaCO3)=4.30g-2.33g=1.97g����n(BaCO3)= ![]() ������NaOH��Һ����1.12L����������壬����Һ����NH4+��NH3��0.05mol����n(NH4+)=0.05mol��CO32����SO42�������ĸ���ɵ����ʵ���Ϊ0.01mol��2��0.01mol��2=0.04mol��NH4����������ɵ����ʵ���Ϊ0.05mol��1=0.05mol�����ݵ���غ㣬�����ƶϳ���Һ��һ����Cl-��������Ϊ0.01mol����Ϊ���ж��Ƿ���Na+�������Na+����Ҫ���ڵ�Cl-ȥ������Һ�ĵ����ԣ���
������NaOH��Һ����1.12L����������壬����Һ����NH4+��NH3��0.05mol����n(NH4+)=0.05mol��CO32����SO42�������ĸ���ɵ����ʵ���Ϊ0.01mol��2��0.01mol��2=0.04mol��NH4����������ɵ����ʵ���Ϊ0.05mol��1=0.05mol�����ݵ���غ㣬�����ƶϳ���Һ��һ����Cl-��������Ϊ0.01mol����Ϊ���ж��Ƿ���Na+�������Na+����Ҫ���ڵ�Cl-ȥ������Һ�ĵ����ԣ���
A. ��ԭ��Һ�в����� Na+���� c(Cl��)= ![]() ��A����
��A����
B. ԭ��Һ��һ����Cl-��������Na+��B����
C. �����㣬ԭ��Һ�У�n(CO32-)=0.01mol����c(CO32-)=0.01mol��0.1L=0.1mol L��1��C����
D. ����BaCl2��Һ֮���г������ɣ��Ҽ����������֮�����������٣���˵��һ����CO32����SO42�����������ӣ�һ��û��Fe3+��D��ȷ��
�ʺ���ѡ��ΪD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij�������Ƹ﹤ҵ������CrԪ�صĻ����������ù�������(�����ȡҺ�н���������Ҫ��Cr3���������Fe3����Fe2����Al3����Ca2����Mg2��)��
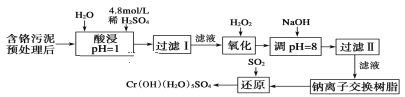
�����²���������������������ʽ����ʱ��Һ��pH������
������ | Fe3�� | Fe2�� | Mg2�� | Al3�� | Cu2�� | Cr3�� |
��ʼ����ʱ��pH | 1.9 | 7.0 | �� | �� | 4.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(��9�ܽ�) |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��___(дһ������)��
��2����pH��8��Ϊ�˳�ȥ___(��Fe3����Al3����Ca2����Mg2��)��
��3������ƽ������ԭ��Ӧ����ʽ��_Na2Cr2O7��_SO2��_H2O=________Cr(OH)(H2O)5SO4��_Na2SO4��ÿ����1molCr(OH)(H2O)5SO4����SO2�����ʵ���Ϊ___��
��4��ӡˢ��·ͭ�帯ʴ������FeCl3����ʴͭ���Ļ����Һ�У���Cu2����Fe3����Fe2����Ũ�Ⱦ�Ϊ0.10mol/L��������ϱ����������ݺ��ṩ��ҩƷ��������ȥCuCl2��Һ��Fe3�� ��Fe2����ʵ�鲽�裺��___����___���۹��ˡ�(�ṩ��ҩƷ��Cl2��ŨH2SO4��NaOH��Һ��CuO��Cu)��