题目内容
(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率.
| c2(NH3) |
| c(N2)?c3(H2) |
(2)根据氨气的浓度计算氢气浓度变化量,氢气平衡浓度+氢气浓度变化量=氢气起始浓度;
(3)根据氨气的浓度计算氮气的浓度变化量,再根据c=
| △c |
| △t |
(4)氮气的平衡浓度+氮气浓度变化量=氮气的起始浓度,氮气转化率=
| 氮气浓度变化量 |
| 氮气起始浓度 |
(1)平衡常数K=
| c2(NH3) |
| c(N2)?c3(H2) |
| 52 |
| 5×103 |
答:该温度下反应的平衡常数为0.005.
(2)根据方程式可知,氢气的浓度变化量=5mol/L×
| 3 |
| 2 |
答:氢气起始浓度为17.5mol/L.
(3)根据方程式可知,氮气的浓度变化量=5mol/L×
| 1 |
| 2 |
| 2.5mol/L |
| 2min |
答:用N2表示该反应的平均反应速率为1.25mol/(L.min).
(4)氮气的起始浓度=5mol/L+2.5mol/L=7.5mol/L,故氮气转化率=
| 2.5mol/L |
| 7.5mol/L |
答:氮气的转化率为33.3%.

(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴ 在一定体积的密闭容器中,进行化学反应: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:

①该反应正向反应是 反应。(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是 。
A.容器压强不变 B.混合气体中c(CO2)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
③当其他条件不变时,若缩小容器的体积,该反应平衡 移动。(选填“正向”、“逆向”或“不”)
⑵工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g)
△H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g)
△H=-49.0 kJ·mol-1
①该反应的平衡常数表达式K= 。
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同)。测得CH3OH的物质的量随时间变化如图所示:

曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(选填“>”、“=”或“<”)。
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
|
容 器 |
甲 |
乙 |
|
反应物投入量 |
1molCO2、3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
经测定甲容器经过5min达到平衡,平衡时CO2的转化率为50%,甲容器中该反应在5min内的平均速率υ(H2)= mol·L-1·min-1。
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.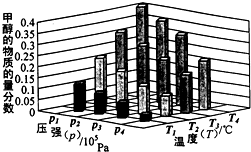 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.