题目内容
【题目】已知A是灰黑色、有金属光泽的固体单质。根据如图所示的物质之间的转化关系,回答下列有关问题。
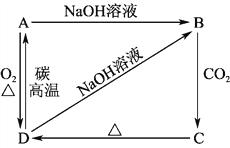
(1)写出A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出D→A的化学方程式:__________________________________________。
(3)写出下列反应的离子方程式。
B→C:____________________________________;
D→B:____________________________________。
【答案】 Si Na2SiO3 H2SiO3 SiO2 SiO2+2C![]() Si+2CO↑ SiO
Si+2CO↑ SiO![]() +CO2+H2O===H2SiO3↓+CO
+CO2+H2O===H2SiO3↓+CO![]() SiO2+2OH-===SiO
SiO2+2OH-===SiO![]() +H2O
+H2O
【解析】本题无机推断,(1)A是灰黑色,且A是有金属光泽的固体单质,因此A为Si,根据转化关系,B为Na2SiO3、C为H2SiO3、D为SiO2;(2)D→A,利用SiO2与C的反应,即SiO2+2C![]() Si+2CO↑;(3)B→C:利用碳酸的酸性强于硅酸,离子反应方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,D→B:SiO2属于酸性氧化物,离子反应方程式为SiO2+2OH-=SiO32-+H2O。
Si+2CO↑;(3)B→C:利用碳酸的酸性强于硅酸,离子反应方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,D→B:SiO2属于酸性氧化物,离子反应方程式为SiO2+2OH-=SiO32-+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组离子在水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42-B.Na+、CO32-、Cl-、K+
C.Mg2+、Ag+、NO3-、Cl-D.H+、Cl-、Na+、CO32-
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .