题目内容
12.下列有关强、弱电解质的叙述正确的是( )| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
分析 A.溶液的导电能力与离子的浓度有关,与电解质的强弱无关;
B.有些强电解质为共价化合物,有些弱电解质为离子化合物;
C.根据强电解质的定义分析,强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物;
D.每一种弱电解质电离的程度各不相同,有本身的性质决定.
解答 解:A.溶液的导电能力与离子的浓度有关,浓度越大导电能力越强,浓度越小导电能力越弱.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物,溶液的导电能力与电解质的强弱无关,如硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,CH3COOH为弱电解质,易溶于水,当乙酸浓度比较大时,离子的浓度大,导电能力强,故A错误;
B.氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,故B错误;
C.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,电解质的水溶液中不存在溶质分子,故C正确;
D.不同弱电解质电离程度由本性决定,浓度相同的弱电解质溶液中电离程度不一定相同,故D错误;
故选C.
点评 本题考查了导电能力大小与强弱电解质的关系,注意“导电能力大小与离子浓度有关,与电解质强弱无关”是解答本题的关键,题目较简单.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
2. 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512K时,图中N点v(正)<v(逆) |
20.还原性的无水草酸是无色无臭的透明结晶或白色粉末.草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳.
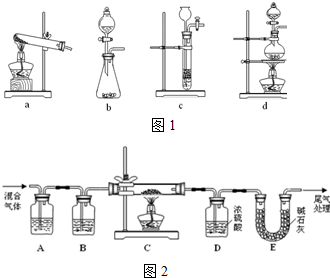
(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.

(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.
7.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 生产粗硅 | B. | 海水提镁 | C. | 电解冶铝 | D. | 生产硫酸 |
17.100mL6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤CuSO4溶液.
①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤CuSO4溶液.
| A. | ①②⑤ | B. | ①④ | C. | ②③ | D. | ③④⑤ |
1.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
2.蒽(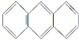 )和菲(
)和菲(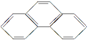 )都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
)都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
 )和菲(
)和菲( )都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
)都是比较简单的稠环芳香烃,有关它们的说法正确的是( )| A. | 蒽和菲属于同系物 | |
| B. | 蒽和菲属于同分异构体 | |
| C. | 蒽的一氯代物有3种,而菲的一氯代物有5种 | |
| D. | 蒽和菲均可以看成是苯的同系物 |

 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步: