题目内容
(7分)(1)室温下,将1g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8kJ的热量,写出C6H6燃烧的热化学方程式 。
(2)今有两个氢气燃烧生成水的热化学方程式
H2(g)+1/2O2(g) ==H2O(g) △H=a kJ/mol
2H2(g)+O2(g) ==2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:b表示b的绝对值)
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)bkJ
②反应热的关系:2a b(填“>”、“<”或“=”)。
③ 若已知H2(g)+1/2O2(g) ==H2O(g) △H=―242 kJ/mol ,且氧气中1mol氧氧键完全断裂时吸收热量496kJ,水蒸气中1molH―O键形成时放出热量463kJ,则氢气中1molH―H键断裂时吸收的热量为(1)C6H6(1)+15/2O2(g) 3H2O(1)+6CO2(g) △H=-3260.4kJ/mol(或其它合理答案,3分)
(2)①<(1分)② >(1分)③ 436kJ(2分)

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
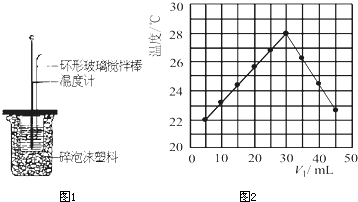
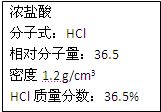 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: