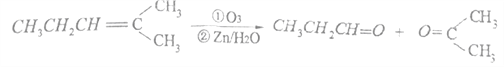题目内容
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
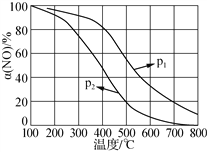
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
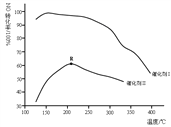
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
【答案】N2+O2![]() 2NO > NO2几乎完全分解 -1632.5kJ/mol 低温下有很高的催化活性,副反应少 不是,主反应为放热反应,NO的平衡转化率应随温度升高而降低 2NO2+ CO32﹣
2NO > NO2几乎完全分解 -1632.5kJ/mol 低温下有很高的催化活性,副反应少 不是,主反应为放热反应,NO的平衡转化率应随温度升高而降低 2NO2+ CO32﹣![]() NO3﹣+ NO2﹣+CO2 5.1×106 0.034mol/L 滴入硝酸银溶液后:c(NO2-)≈1.0×10-6mol/L,
NO3﹣+ NO2﹣+CO2 5.1×106 0.034mol/L 滴入硝酸银溶液后:c(NO2-)≈1.0×10-6mol/L,![]() ≈1.0×10-3mol/L,c(NO2-)×c(Ag+)≈1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀
≈1.0×10-3mol/L,c(NO2-)×c(Ag+)≈1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀
【解析】
(1)①汽车点火时,空气中的氮气与氧气反应生成一氧化氮,化学方程式:N2+O2![]() 2NO;②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
2NO;②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(2)根据三个副反应可知主反应的ΔH=③![]() 2-①=-1632.5kJ/mol;选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,故答案为:低温下有很高的催化活性,副反应少;观察图象可知,低于210℃时,NO的转化率随温度升高而增大,主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致。故不是,理由是主反应为放热反应,NO的平衡转化率应随温度升高而降低;
2-①=-1632.5kJ/mol;选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,故答案为:低温下有很高的催化活性,副反应少;观察图象可知,低于210℃时,NO的转化率随温度升高而增大,主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致。故不是,理由是主反应为放热反应,NO的平衡转化率应随温度升高而降低;
(3)用Na2CO3溶液吸收NO2生成CO2,,每4.6gNO2,即0.1mol NO2反应时转移电子数为0.05mol,则反应的离子方程式:2NO2+ CO32﹣![]() NO3﹣+ NO2﹣+CO2;
NO3﹣+ NO2﹣+CO2;
(4)①HNO2![]() H++NO2-,则
H++NO2-,则![]() ,求算得5.1×106;②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-) +c(OH-),可求c(NO3-)约为0.034mol/L;③滴入硝酸银溶液后:c(NO2-)≈1.0×10-6mol/L,
,求算得5.1×106;②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-) +c(OH-),可求c(NO3-)约为0.034mol/L;③滴入硝酸银溶液后:c(NO2-)≈1.0×10-6mol/L,![]() ≈1.0×10-3mol/L,c(NO2-)×c(Ag+)≈ 1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀。
≈1.0×10-3mol/L,c(NO2-)×c(Ag+)≈ 1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀。