题目内容
3.下列物质,既能与盐酸反应又能与氢氧化钠溶液反应的是( )| A. | AlCl3 | B. | Al(OH)3 | C. | KOH | D. | HCl |
分析 Al、Al2O3、Al(OH)3、弱酸的酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和强酸、强碱反应,据此分析解答.
解答 解:A.氯化铝是强酸弱碱盐,能和NaOH发生复分解反应,和稀盐酸不反应,故A错误;
B.氢氧化铝属于两性氢氧化物,能和稀盐酸、NaOH溶液发生生成可溶性盐,故B正确;
C.KOH属于强碱,只能和稀盐酸发生复分解反应,和NaOH不反应,故C错误;
D.HCl属于酸,只能和NaOH发生复分解反应,故D错误;
故选B.
点评 本题考查两性氢氧化物、两性氧化物等知识点,侧重考查元素化合物知识,熟悉常见元素化合物知识,总结归纳并灵活运用,注意氢氧化铝不溶于弱碱,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.如表是元素周期表的一部分,根据所给的10 种元素,回答下列问题.
(1)金属性最强的元素是Na,最稳定的气态氢化物是HF(填化学式),适合制造半导体材料的元素是Si;
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
14.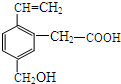 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )
①能发生氧化反应;②能使溴水褪色;③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加成反应;⑥能发生银镜反应.
 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )①能发生氧化反应;②能使溴水褪色;③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加成反应;⑥能发生银镜反应.
| A. | 只有②④ | B. | 只有②③④ | C. | 只有①②③④⑤ | D. | 全部 |
11.电解精炼粗铜时,下列叙述不正确的是( )
| A. | 与电源正极相连的电极是粗铜板 | B. | 阴极发生反应:Cu2++2e-═Cu | ||
| C. | 电解池的阳极材料为粗铜 | D. | 粗铜板上发生还原反应 |
18.以下物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | SO2→SO3→H2SO4→MgSO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→NaCl→NaOH→Na2CO3 |
8.浓硫酸不具有的性质是( )
| A. | 吸水性 | B. | 腐蚀性 | C. | 强氧化性 | D. | 易挥发性 |
12.下列说法正确的是( )
| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
13.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
 (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)