题目内容
某化学反应其△H=-122kJ/mol△S=-431J/(mol*K) 则以下关于此反应的自发性描述正确的是( )
| A、任何温度下都能自发进行 |
| B、仅在低温下自发进行 |
| C、仅在高温下自发进行 |
| D、在任何温度下都不能自发进行 |
考点:焓变和熵变
专题:
分析:反应能否自发进行,决定于△H-T△S的大小,△H-T△S<0时反应能自发进行,△H-T△S>0时,反应不能自发进行,据此分析.
解答:
解:本题中△H-T△S=-122KJ/mol-[-0.431KJ/(mol?K)T]=-122KJ/mol+0.431KJ/(mol?K)T,当T数值不大时,△H-T△S<0,反应在低温下可以自发进行,故选:B.
点评:本题考查反应能否自发进行的条件,△H-T△S的大小决定反应能否自发进行,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
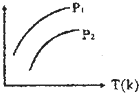 下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )
下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )①一定条件下L的转化率
②混合气体中M的百分含量
③混合气体中L的百分含量
④混合气体中的平均相对分子质量.
| A、①② | B、①③ | C、②④ | D、③④ |
下列说法正确的是( )
| A、酸性氧化物一定不能和酸反应 |
| B、由同种元素组成的物质一定是纯净物 |
| C、因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 |
| D、Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 |
在相同温度下,发生下列反应:
2H2(g)+O2(g)→2H2O(l)+Q1 2H2(g)+O2(g)→2H2O(g)+Q2
则上述Q1、Q2的大小关系是( )
2H2(g)+O2(g)→2H2O(l)+Q1 2H2(g)+O2(g)→2H2O(g)+Q2
则上述Q1、Q2的大小关系是( )
| A、Q1=Q2 |
| B、Q1>Q2 |
| C、Q1<Q2 |
| D、不确定 |
配置0.5mol/L的碳酸钠溶液250mL时,下列仪器不需要的是( )
A、 |
B、 |
C、 |
D、 |
已知1g氢气燃烧生成液态水时放出142.9KJ热量,则反应的热化学方程式为( )
| A、2H2(g)+O2(g)═2H2O(l);△H=-571.6KJ?mol-1 | ||
B、H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ | ||
| D、2H2+O2═2H2O;△H=-571.6kJ |
下列说法正确的是( )
A、按照系统命名法, 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |
B、 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 |
C、1mol 可以与2mol NaOH反应 可以与2mol NaOH反应 |
D、1mol绿原酸 通过消去反应脱去1mol H2O时,能得到6 种不同产物(不考虑立体异构) 通过消去反应脱去1mol H2O时,能得到6 种不同产物(不考虑立体异构) |
硫酸型酸雨主要由SO2形成.1mol SO2的质量为( )
| A、16g | B、32g |
| C、48g | D、64g |
不能通过两种单质间化合直接得到的是( )
| A、FeS |
| B、CuCl2 |
| C、HCl |
| D、FeCl2 |