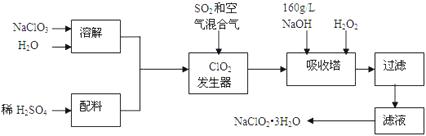
��Ŀ����
����Ŀ������ͭ��ȡ��M��ͨ�����·�Ӧʵ��ͭ���ӵĸ�����
��1��X������ˮ���������л��ܼ����侧������Ϊ��
��2��X����sp2�ӻ���sp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С˳��Ϊ��
��3��������Ӧ�ж��Ѻ����ɵĻ�ѧ����������ţ���
a.���Ӽ� b.��λ�� c.������ d.���»��� e.���ۼ�
��4��M��W�����ӽṹ��ͼ����ȣ�M��ˮ����С��������Cu2+����ȡ��Mˮ����С����Ҫԭ������
��5������ͭ���壬�׳����������������д��£�����ⶾ�ȹ�Ч��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���(����ͺ��������ͬ��ԭ��)��
�ٸ��¶�����
��ͭԭ�ӵ���λ������
���𰸡�
��1�����Ӿ���
��2��N��O��C
��3��be
��4��M���γɷ����������ʹ�ܽ�ȼ�С
��5��1000�����ϣ�4
���������⣺��1����������X�Ľṹ��ʽ�жϣ�X������ˮ���������л��ܼ�����XΪ���Ӿ��壬
���Դ��ǣ����Ӿ��壻
��2��������X�б���C���ʻ�C��sp2�ӻ�����sp3�ӻ���ʽ��ԭ����O��N��C������Nԭ��2p������������һ�����ܸ���O����һ�������ɴ�С˳��Ϊ��N��O��C��
���Դ��ǣ�N��O��C��
��3���ɽṹ��ʽ��֪X�����д�����λ�����ۼ���
���Դ��ǣ�be��
��4������M���γɷ�����������������ܽ�ȼ�С��
���Դ��ǣ�M���γɷ����������ʹ�ܽ�ȼ�С��
��5������ͼ��֪��ֻ����2��ԭ�ӣ���ΪCu��O���þ�����Oԭ����Ϊ1+8��![]() =2��
=2��
Cuԭ����Ϊ4���仯ѧʽΪCu2O������ͭ�����ʵ���=![]() =0.02mol��
=0.02mol��
������ͭ������=0.01mol��144g/mol=1.44g�����Լ����¶���1000�����ϣ����Դ��ǣ�1000�����ϣ�
����ͼ��֪Cu����λ��Ϊ4�����Դ��ǣ�4��